Какая кислота в аккумуляторе серная или соляная
Практически все владельцы личного транспортного средства прекрасно знают о том, что в аккумуляторах есть кислота. Даже новички, которые только начинают постигать азы вождения, и то осведомлены касательно этого вопроса.
Многие из них слышали о кислотно-свинцовых аккумуляторах, но на деле так и не имеют представления, как именно работает это устройство. А между тем здесь протекают определенные химические реакции.
Какая кислота в аккумуляторе и для чего нужна
Большинство автомобилистов прекрасно знают, какая кислота залита в аккумуляторе. Но находятся и те, кто считают, что внутри аккумулятора ничего кроме дистиллированной воды (или дистиллята) нет. Другие же придерживаются мнения в пользу соляной кислоты, которое также неверно.
В любой автомобильной батарее содержится серная кислота — H2SO4. Если быть точнее, то речь идет о растворе серной кислоты с дистиллированной водой.
Это основной компонент для работы АКБ. В отсутствие кислоты невозможен процесс заряда и разряда батареи. Это одна из самых активных разновидностей, которая способна вступать во взаимодействие практически с любым металлом, включая их оксиды. К тому же кислота может вступать в реакции обмена, а ее активность зависит от содержания воды.
Когда происходит заряд кислотного аккумулятора, пластины из чистого свинца (отрицательные) начинаются выделять электроны, которые принимаются решетками из оксида свинца (положительные). При разряде батареи происходит в точности до наоборот. Иными словами, когда пластины отдают электроны, они как бы «разрушаются» – происходит заряд, а при разряде они возвращаются обратно, что именуется «восстановлением».
И вот как раз для такого процесса разрушения – восстановления и нужна агрессивная среда в виде разбавленной серной кислоты. И без нее эффективность автомобильных батарей была бы на очень низком уровне.
Состав электролита и как правильно сделать
Серная кислота широко используется в современной промышленности для получения электрической энергии (аккумуляторы, батареи, электрические конденсаторы). Что касается состава электролита в АКБ, то соотношение между серной кислотой и дистиллированной водой следующее:
- сама кислота – 30%;
- дистиллированная вода – 70%.
Именно такая субстанция эффективным образом взаимодействует со свинцовыми пластинами. При этом особого внимания заслуживает плотность электролита, на что непосредственным образом оказывает влияние серная кислота. У концентрированной она достигает показателя в 1,83 г/см 3 . Добавлением дистиллированной воды обеспечивается понижение плотности до нужных пределов – обычно это диапазон 1,23-1,27 г/см 3 .
| Плотность электролита (г/см3) | Напряжение без нагрузки (В) | Напряжение с нагрузкой (В) | Степень заряженности (%) | Замерзание электролита (С) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,2 | 12,24 | 9,74 | -27 | |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Знать этот параметр необходимо для понимания порога замерзания электролита.
Да, это действительно возможно, только действовать необходимо с предельной осторожностью. И поскольку предстоит иметь дело с серной кислотой высокой концентрации, то такая работа представляет определенную опасность. Необходимо позаботиться о защите рук, тела, органов дыхания.
Собственно в том, чтобы самостоятельно приготовить электролит для АКБ, нет ничего сложного – смешать серную кислоту с дистиллированной водой, соблюдая пропорцию. Стоит заметить, что обычна вода из-под крана для таких целей не подходит, поскольку содержит большое количество разных примесей, которые негативным образом воздействуют на свинцовые пластины.
Собственно сами ингредиенты:
- Серная кислота (плотность должна быть 1,83 г/см 3 или более, но не менее).
- Дистиллированная вода.

- Любая фарфоровая посуда.
Пропорции кислоты и воды нам известны – 30% и 70% соответственно. При этом важен характер подхода к производству – оптимально кислоту добавлять в воду, а не наоборот. Также стоит учесть, что при их смешивании будет выделяться очень много тепловой энергии и по этой причине недопустимо использовать стеклянную посуду – она просто лопается. Когда температура электролита упадет, его можно перелить в стеклянную емкость или тару из пластика.
После того как жидкости будут соединены, следует замерить плотность ареометром. Если показатели соответствуют допустимому пределу, электролит готов к эксплуатации. Но такое приспособление имеется далеко не у каждого водителя, а поэтому пригодится следующая подсказка плотности электролита (из расчета на 1 литр дистиллированной воды):
- при 1,23г/см 3 – 280г;
- при 1,25г/см 3 – 310г;
- при 1,27г/см 3 – 345 г;
- при 1,29г/см 3 – 385 г.
Собственно на этом работа и заканчивается. Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см 3 . При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см 3 , а жарких субтропических районов – 1,24-1,26 г/см 3 . Пределы плотности от 1,27 г/см 3 до 1,29 г/см 3 актуальны для тех регионов, где зима свирепствует до -50 °С.
Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см 3 . При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см 3 , а жарких субтропических районов – 1,24-1,26 г/см 3 . Пределы плотности от 1,27 г/см 3 до 1,29 г/см 3 актуальны для тех регионов, где зима свирепствует до -50 °С.
К чему приведет нарушение рецептуры
Показатель в 1,29 г/см 3 является не самым высоким – встречается концентрат электролита с плотностью 1,33 г/см 3 (применяется для корректировки), ранее можно было найти даже с плотность 1,4 г/см 3 , но сейчас он снят с продажи. Однако его все же следует также разбавить водой и только после этого заливать внутрь АКБ. Почему же нельзя лить сильно концентрированный электролит?
Ничего хорошо уж точно не произойдет! Из-за высокой концентрации страдают пластины аккумулятора – их просто разъедает со временем. Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.
Низкая плотность электролита приводит к такому явлению, которое называется сульфатацией. Об этом процессе известно многим опытным водителям. В результате на пластинах оседают кристаллы сульфита свинца, из-за чего металл утрачивает способность к накоплению заряда.
К тому же, как выше уже было упомянуто, из-за слишком низких показателей плотности электролит замерзает, обращаясь в лед. Чем это грозит, каждому уже понятно – повреждения пластин не избежать.
Как корректировать плотность жидкости
Владельцам автомобилей необходимо контролировать уровень электролита и его плотность. Из-за гидролиза и нагрева АКБ в подкапотном пространстве содержание субстанции понижается, а плотность наоборот растет. По этой причине возникает необходимость доливать дистиллированную воду. Но иногда показатели плотности электролита могут стать меньше нормы. Тогда следует поднять концентрацию кислоты.
Существуют несколько способов как это можно сделать, исходя из степени понижения плотности электролита.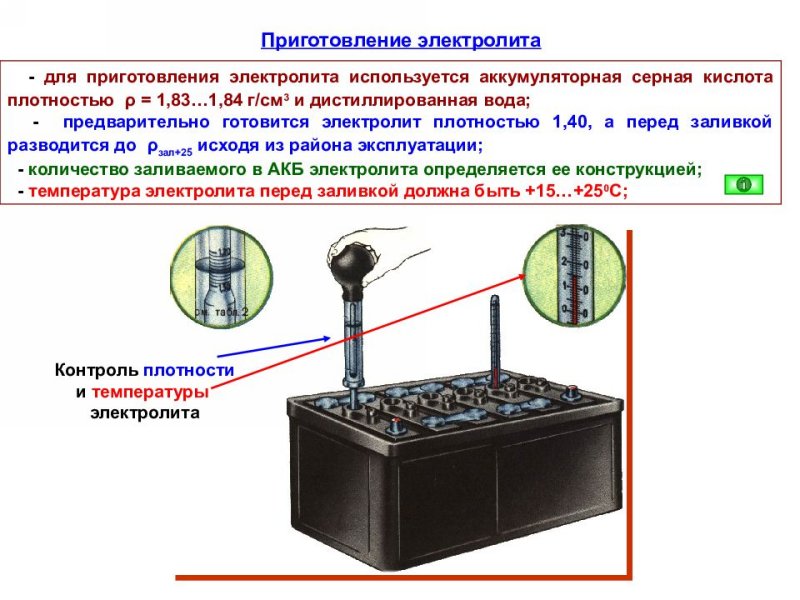 Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см 3 до 1,20 г/см 3 , то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см 3 . Иными словами делается повышение плотности электролита.
Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см 3 до 1,20 г/см 3 , то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см 3 . Иными словами делается повышение плотности электролита.
Только предварительно стоит убедиться в том, что АКБ заряжена, иначе батарею следует подзарядить. При низком заряде аккумулятора к такой процедуре нельзя приступать. Иначе концентрация H
Сама же процедура выполняется в следующем порядке:
- Резиновой грушей откачивает как можно больше жидкости из банки. При этом замерить объем.
- Добавляют новый корректирующую жидкость с плотностью 1,27-1,29 гр/см3 в количестве равном половине изъятого объема.
- Пусть все перемешается между собой – для этого можно дать нагрузку на выводы, просто подождать некоторое время или потрясти АКБ.

- Замеряют плотность. Если показатели по-прежнему не достигли допустимых пределов доливку электролита стоит продолжать до достижения нужных параметров.
- Когда предел установлен, банки закрывают, а сам аккумулятор ставится на зарядку.
В том случае, когда плотность электролита снижена ниже уровня в 1,2 гр/см3, тогда необходимо менять его полностью – сливать старый, заливать новый.
Многие автовладельцы даже не задумываются, какая кислота залита в АКБ автомобиля и по незнанию высказываются неверные предположения. Некоторые говорят, что там вода, а некоторые считают, что соляная кислота, поэтому стоит подробнее разобраться в этом вопросе. В свинцово-кислотном аккумуляторе залита дистиллированная вода и серная кислота. Такая жидкость имеет название электролит.
Какую кислоту заливают в аккумулятор
В некоторых видах автомобильных АКБ в качестве электролита может использоваться щелочь. К примеру, никель-кадмиевый тип АКБ. Помимо этого, есть группа гелевых аккумуляторов, где жидкость находится в связанном состоянии. Но, по сути, это раствор серной кислоты, переведенный в гелеобразное состояние или им пропитанное стекловолокно.
Но, по сути, это раствор серной кислоты, переведенный в гелеобразное состояние или им пропитанное стекловолокно.
Серная кислота широко используется при производстве свинцово-кислотных АКБ для транспортных средств. Ее концентрация в электролите около 30-35%, остальное – дистиллированная вода. Применять обычную водопроводную воду запрещено, поскольку в ее состав входят соли многих металлов и их попадание в АКБ сократит срок его службы.
Как правило, в бытовой сфере серной кислоты с 30%процентов вполне достаточно, однако в сфере производства довольно часто используется кислота с более высокой концентрацией. Получить концентрированную серную кислоту можно в две стадии. Первая – это когда концентрация доводится до 65-70%, вторая – когда ее увеличивают до 98%. Такой состав наиболее пригоден для длительного хранения. Возможно получение высокой концентрации в 99 %, но в дальнейшем из-за значительной потери SO3 она снизится до 98,3%.
Применение серной кислоты и ее сорта
Существует несколько сортов серной кислоты, к ним относятся:
- Нитрозная или башенная.
 Концентрация составляет 75%, а плотность этого сорта находится в пределах 1,67 г/см 3 . Такое название он получил благодаря методу производства нитрозным способом в футерованных башнях. Обжиговый газ обрабатывается нитрозой и в процессе реакции получается кислота и оксиды азота.
Концентрация составляет 75%, а плотность этого сорта находится в пределах 1,67 г/см 3 . Такое название он получил благодаря методу производства нитрозным способом в футерованных башнях. Обжиговый газ обрабатывается нитрозой и в процессе реакции получается кислота и оксиды азота. - Контактная. Концентрация достигает 92,5-98%, плотность – 1,837 г/см 3 . Данный сорт также получается из обжигового газа с содержанием двуокиси SO2. В процессе химической реакции происходит ее окисление при контакте с катализатором из ванадия.
- Аккумуляторная. Концентрация 92-94%, плотность – 1,835 г/см 3 .
- Сорт Олеум. Концентрация довольна высокая –104,5%, плотность – 1,897 г/см 3 , представляет собой концентрированный раствор из кислоты и SO3.
- Высокопроцентный олеум. Концентрация достаточно высокая –114,6%, плотность – 2,002 г/см 3 .
Процессы, происходящие в АКБ с участием электролита
Функционирование свинцово-кислотного АКБ основывается на химических процессах, протекающих с помощью электролита. АКБ автомобиля из пластин: положительных и отрицательных, погруженных в раствор кислоты. Пластины имеют токоотводящие решетки, выполненные из свинца с добавками (зависит от типа АКБ), а на решетках отрицательных электродов нанесен сероватый порошок свинца, на положительных – красновато-коричневый диоксид свинца.
АКБ автомобиля из пластин: положительных и отрицательных, погруженных в раствор кислоты. Пластины имеют токоотводящие решетки, выполненные из свинца с добавками (зависит от типа АКБ), а на решетках отрицательных электродов нанесен сероватый порошок свинца, на положительных – красновато-коричневый диоксид свинца.
Показатель плотности электролита на заряженном АКБ находится в диапазоне 1,128─1,300 г/см 3 . При разрядке АКБ в результате химической реакции из электролита стремительно расходуется кислота и плотность значительно падает.
Полностью заряженный элемент аккумулятора транспортного средства выдает напряжение в пределах 2,5-2,7 В без нагрузки на выводах. В случае нагрузки данное напряжение несколько проседает до 2,1 В буквально за несколько минут. За этот короткий период на поверхности отрицательных электродов успевает сформироваться плотный слой PbSO4. Соответственно, напряжение элемента на подключенной к авто АКБ составляет 2,15 В.
Если разряжать АКБ транспортного средства небольшим током (примерно 10% от номинальной емкости), тогда через 1-2 ч разрядки напряжение элемента снизится до 2 В. Это обусловлено тем, что в этом момент формируется большое количество PbSO4, который, в свою очередь сильно забивает поры активной массы. Помимо этого, проявляется рост внутреннего сопротивления элементов аккумулятора и значительно снижается концентрация жидкости.
Это обусловлено тем, что в этом момент формируется большое количество PbSO4, который, в свою очередь сильно забивает поры активной массы. Помимо этого, проявляется рост внутреннего сопротивления элементов аккумулятора и значительно снижается концентрация жидкости.
Контроль за состоянием электролита
Контроль за электролитом – важная процедура, которая должна проводиться регулярно. От владельца транспортного средства требуется контролировать как уровень электролита в АКБ, так и его плотность. Чтобы проверить уровень электролита рекомендуется использовать стеклянную трубочку, но если ее нет, то можно использовать прозрачный корпус от ручки. Для измерения нужно открыть пробки всех банок и погрузить пластиковую/стеклянную трубочку до пластин. После чего с верхнего конца ее плотно зажать пальцем и поднять.
Оптимальный уровень электролита в трубке должен быть 10-12 мм. В случае нехватки электролита доливается вода до требуемого уровня. Выше необходимого уровня воду заливать не следует.
Срок службы электролита
Стоит знать, что кислотный электролит – это раствор, который не имеет срока годности. Срок службы для такой жидкости определяется исключительно исходя из того, как она способна выполнять свои функции.
К показателям, которые влияют на срок использования АКБ, относятся:
- Плотность электролита.
- Температурный режим функционирования АКБ.
- Степень заряженности аккумулятора.
Если эти показатели соответствуют норме, срок службы электролита довольно продолжительный.
Как поднять плотность электролита
Повышение плотности жидкости происходит вследствие повышения температуры и в результате процесса, который называется гидролиз. Чтобы этот показатель находился на необходимом уровне, требуется регулярное добавление дистиллята. Если датчик концентрации кислоты в электролите показывает значение ниже, чем 1,275 г/см 3 , следует его поднимать.
Кислотность электролита можно поднять двумя способами: полной заменой старого электролита на новый или внесением разбавленной концентрированной кислоты.
В случае разбавления жидкости следует провести ряд действий для каждой банки:
- Постараться откачать максимальное количество электролита посредством шприца или резиновой груши.
- Внести в банку 0,5 его объема плотностью от 1,26 до 1,28 г/см 3 .
- Чтобы тщательно перемешать жидкость, необходимо на выводы подать нагрузку с минимальной мощностью.
При замере плотности стоит определить необходимый уровень. Если не произошло изменений, тогда в половину оставшегося объема требуется внести еще электролит.
С помощью подобных манипуляций можно довести до оптимальной плотности концентрацию кислоты в электролите.
В случае, если показатель индикатора показывает значения плотности ниже, чем 1,2 г/см 3 , требуется полная замена электролита, так как способом доливки поднять ее не получится. Однако если батарее менее года, то стоит попробовать.
Важно! Серная кислота – агрессивная средой для кожных покровов человека и его одежды. Поэтому во время работ с открытой батареей рекомендуется позаботиться о мерах защиты: обязательно надеть резиновые перчатки, защитные очки. Так же пригодится прорезиненный фартук.
Так же пригодится прорезиненный фартук.
Порядок заливки и доливки кислотного электролита в АКБ
Составляющие компоненты электролита – кислоту и дистиллированную воду, нужно смешать в разных пропорциях. Так, если необходимо получить электролит с уровнем плотности 1,29 г/см³, то к 1 литру необходимо добавить 0,36 л кислоты, то есть в соотношении 1:3.
Заливку электролита производят стеклянной или полиэтиленовой трубочкой до уровня 10-15 мм над свинцовыми пластинами. После этого аккумулятор оставляют на два часа, однако в некоторых случаях плотность при этом падает. Далее АКБ заряжают током в десять раз меньшим его емкости в течение 4 часов.
Проверять плотность АКБ необходимо раз в 2-3 месяца. Для этого используется специальный прибор – ареометр.
Важно! В целях техники безопасности необходимо знать, что заливать нужно именно серную кислоту в дистилированную воду, но не наоборот, поскольку высока вероятность возникновения химической реакции данной смеси с выделением брызг и тепла.
Процесс приготовления электролита
Электролит для АКБ можно, конечно, приобрести в специализированных магазинах, но можно сделать его самостоятельно и при этом научиться регулировать плотность.
Для приготовления электролита потребуются следующие компоненты:
- Вода дистиллированная.
- Серная кислота.
- Емкость из материала, устойчивого к воздействию концентрированного химического вещества: стекла, керамики, свинца.
- Эбонитовая палочка (для размешивания жидкости).
Для приготовления в специальную емкость заливается вода, после – серная кислота. Компоненты тщательно палочкой смешиваются. Процедуру проводят последовательно, поскольку при обратном варианте есть вероятность получить ожоги.
Полученное вещество плотно накрывается и оставляется минимум на сутки до выпадения осадка и остывания. Стоит знать, что при обратном проведении заливки (сначала серная кислота, потом – вода), возможна гидратации и образование в кислоте тепла. Соответственно, вода может закипеть и спровоцировать разбрызгивание.
Соответственно, вода может закипеть и спровоцировать разбрызгивание.
Срок службы АКБ ограничен ее техническими характеристиками. Однако при неправильном его использовании и хранении этот показатель может существенно снизиться. Чтобы АКБ не изнашивалась слишком стремительно, специалисты рекомендуют следить за плотностью электролита и его уровнем.
Если материал был для вас интересен или полезен, опубликуйте его на своей странице в социальной сети:
Знать, какая кислота в аккумуляторе автомобиля, обязан каждый водитель, самостоятельно обслуживающий своё транспортное средство. Этот вопрос вызван не праздным любопытством, имеющим цель расширить кругозор. Применяя знания такого рода на практике, можно не только продлить срок службы аккумуляторной батареи, но и избежать возникновения неприятных, а подчас и опасных ситуаций, в которые рискует попасть неподготовленный человек.
Для чего нужна кислота
Прежде чем приступать к описанию процессов, протекающих при разряде/заряде, стоит сразу сказать, какая кислота используется в аккумуляторе любого автомобиля – это серная (h3SO4), а не соляная или, например, фосфорная.
Она необходима для приготовления электролита – жидкости, в которой присутствуют заряженные частицы – ионы. Электролит представляет собой не просто пассивный раствор, в котором частицы воды и кислоты перемешаны друг с другом. Это активная жидкость, отличительная особенность которой – постоянное протекание в ней взаимно исключающих друг друга процессов – диссоциации и ассоциации.
В аккумуляторе присутствует серная кислота
При диссоциации, которая протекает лишь в водном растворе h3SO4. Молекулы кислоты образуют ионы с положительными и отрицательными зарядами:
Диссоциация кислоты
Параллельно с диссоциацией протекает обратный процесс – превращение ионов в молекулы кислоты. Полной ионизации электролита, а также полной нейтрализации заряженных частиц не происходит. Процессы находятся в динамическом равновесии, которое может измениться лишь под влиянием внешнего воздействия.
Именно наличие ионов и превращает раствор в электролит. Под влиянием электрического поля (во время зарядки) заряженные частицы переносят заряд к пластинам аккумулятора. При реакции между ионами и веществом пластин происходит высвобождение электронов. Они способны двигаться по проводнику при подключении его к электродам (их выводам).
При реакции между ионами и веществом пластин происходит высвобождение электронов. Они способны двигаться по проводнику при подключении его к электродам (их выводам).
Основные процессы, протекающие при разряде
Отрицательные пластины АКБ и их обмазка изготовлены из свинца (Pb), а у положительных активная масса имеет основой его диоксид (PbO2). Металлический свинец обладает большим количеством свободных электронов, чем его диоксид. Если положительную и отрицательную пластины соединить проводником, то разность потенциалов практически сразу уравновесится и электрический ток не возникнет.
Но если эти пластины погрузить в сернокислотный электролит, то перенос электронов вызовет химические реакции окисления металлического свинца и восстановления его диоксида:
PbO2 + SO42- + 4H++ 2e- = PbSO4 + h3O
Как видите, «конечными продуктами» этих реакций являются:
- Сульфат свинца PbSO4, образующийся на поверхности пластин.
- Вода.

- Свободные электроны (e-), благодаря которым и возникает электрический ток.
При достаточно продолжительном разряде серная кислота может полностью «израсходоваться» на образование сульфата и воды, в результате чего прекратятся химические реакции и свободные электроны не будут образовываться. Поэтому особенно ценным в плане практического использования свинцовых аккумуляторных батарей является возможность протекания обратных реакций при подключении к выводам электрического напряжения.
При зарядке сульфат свинца, прореагировав с водородом, снова становится серной кислотой, в результате чего плотность электролита восстанавливается, а поверхность пластин аккумулятора приобретает первоначальный состав.
Проверка плотности электролита
Состав электролита
Химический состав раствора прост – 35% серной кислоты + 65% воды. Такое соотношение обусловлено как необходимостью сохранить работоспособность батареи при низких температурах (до -65 С). А также избежать чрезмерной коррозии пластин – серная кислота очень агрессивна.
А также избежать чрезмерной коррозии пластин – серная кислота очень агрессивна.
Разумеется, вода должна быть дистиллированной, а кислота соответствовать по чистоте ГОСТ 667-73, устанавливающему минимальные нормы содержания примесей.
При обслуживании аккумуляторов состав аккумуляторной кислоты оценивается по плотности, измеряемой ареометром. При температуре воздуха +20 С её значение должно быть 1,28 г/см3.
Но для автомобилистов необходимость самостоятельно изготавливать электролит для батареи практически отпадает. В автомагазинах продаётся как готовый раствор (плотностью 1,28 г/см3), так и корректирующий (1,4 г/см3). Также можно купить и дистиллированную воду – при необходимости её доливки.
Контроль за состоянием электролита
В первую очередь, на что должен обращать внимание владелец при уходе за батареей – это уровень электролита. Пластины должны быть полностью погружены в раствор. Расстояние от поверхности жидкости до верхнего края пластин – около 10-15 мм.
Знать, сколько жидкости должно быть в аккумуляторе, нужно лишь в тех случаях, когда вы собираетесь её поменять целиком. Объём электролита зависит от ёмкости АКБ, примерные его значения приведены в таблице:
Но замена электролита потребует слива отработанного раствора. Для чего потребуется сверлить корпус батареи и затем восстанавливать его целостность. Опрокидыванием выливать ни в коем случае нельзя. Шлаком, скопившемся на дне, можно спровоцировать замыкание пластин и окончательный выход АКБ из строя.
Поэтому уход за батареей, который имеет практическую значимость, сводится к возобновлению уровня электролита и контролю его плотности.
Akym » Насколько опасна кислота в автомобильном аккумуляторе?
В электролите, который находится внутри всех автомобильных аккумуляторов, содержится разбавленная серная кислота, поэтому они требуют очень осторожного обращения. Обязательно при работе с АКБ и тем более с электролитом надо использовать защитные средства: очки, перчатки и т.д. Если кислота, пусть даже и разбавленная попадет на кожу или в глаза, это может вызвать ожог.
Обязательно при работе с АКБ и тем более с электролитом надо использовать защитные средства: очки, перчатки и т.д. Если кислота, пусть даже и разбавленная попадет на кожу или в глаза, это может вызвать ожог.
Правила обращения с аккумуляторной кислотой
Существует ряд мер, которые помогут избежать серьезной опасности при работе с серной кислотой:
- Необходимо работать только в защитной одежде.
- Кислота, которая вдруг попала на кожу или одежду, следует как можно быстрее нейтрализовать раствором пищевой соды или нашатырного спирта, а затем место повреждения надо тщательно промыть водой.
- Если нейтрализатора под рукой нет, надо смыть кислоту большим количеством воды, после чего надо сразу же обратиться за врачебной помощью.
- При использовании обслуживаемых аккумуляторов иногда приходится изготавливать электролит самостоятельно. При самостоятельном смешивании кислоту надо вливать тонкой струей в воду. Делать наоборот — вливать воду в кислоту нельзя ни в коем случае! В этом случае смесь может начать брызгаться и капли концентрированной кислоты могут попасть на руки или лицо.

- Ставя батарею на зарядку, обязательно выкручивайте пробки, чтобы дать выход газам, которые очень активно выделяются в процессе восстановления АКБ. Это очень важно, так как кислота распадается и выделяется большое количество кислорода и водорода. Если они будут накапливаться внутри, риск взрыва батареи будет очень велик.
Техника безопасности при работе с автоаккумуляторами
Находясь вблизи аккумулятора, который заряжается, надо соблюдать осторожность и несколько простых правил:
- Так как газ, выделяемый при восстановительной реакции очень взрывоопасен, то нельзя допускать в помещении образования искр, нельзя заряжать АКБ вблизи открытого огня, мест для курения и т.д.
- Заряжать аккумулятор рекомендуется в хорошо проветриваемом месте с хорошей вентиляцией.
- При подключении контактов батареи к транспортному средству зажигание должно быть выключено.
- Когда отсоединяете стартерную батарею от автомобиля, первым отключается провод массы, а при подсоединении — наоборот, он подключается последним.

Электролит: основа свинцово-кислотных автомобильных аккумуляторов
В качестве стартерных батарей в автотранспорте используются свинцово-кислотные аккумуляторы. Функционирование аккумулятора обеспечивается специальным раствором серной кислоты — электролитом. О том, что такое аккумуляторный электролит, каких типов он бывает, и как его использовать — читайте в статье.
Что такое электролит?
Аккумуляторный электролит — водный раствор серной кислоты, предназначенный для использования в свинцово-кислотных аккумуляторных батареях (АКБ). Электролит готовится путем растворения концентрированной серной кислоты в дистиллированной воде, молекулы кислоты в данном растворе диссоциируют (распадаются) на ионы — это явление наделяет электролит электропроводящими свойствами.
Аккумуляторный электролит имеет следующее назначение:
- Изготовление аккумуляторных батарей;
- Ввод в эксплуатацию сухозаряженных батарей;
- Восстановление АКБ при загрязнении или утечке электролита, коротких замыканиях между пластинами и других неисправностях.

Но прежде, чем применять электролит для той или иной цели, необходимо разобраться в его характеристиках и особенностях применения.
Зачем в аккумуляторе электролит?
Электролит, свинцовые пластины и пористый диоксид свинца (PbO2) — три основных компонента свинцово-кислотного аккумулятора. Именно в присутствии кислотного электролита протекают электрохимические реакции, делающие возможным накопление и отдачу аккумулятором электрического заряда.
Во время разряда АКБ металлический свинец и оксид свинца вступают в реакцию с серной кислотой (точнее — с ее отрицательными ионами SO4 и положительными ионами H), образуя сульфат свинца (PbSO4) и воду, при этом на анодных пластинах выделяются избыточные электроны. На катодных пластинах, напротив, наблюдается недостаток электронов, благодаря этому при замыкании анода и катода между ними возникает электрический ток. Во время заряда АКБ проходят обратные реакции — под действием тока от стороннего источника из сульфата свинца образуются чистый свинец, диоксид свинца и кислота.
В ходе данных реакций количество серной кислоты и воды в электролите изменяется, что приводит к изменению его плотности и объема. При разряде АКБ концентрация кислоты понижается, а концентрация воды немного увеличивается, что приводит к падению плотности и к некоторому увеличению объема электролита. В процессе заряда плотность повышается, а объем несколько понижается.
Типы и характеристики электролитов
Электролит изготавливается смешиванием концентрированной серной кислоты и дистиллированной воды в строго определенных пропорциях. Для изготовления электролита используется специальная аккумуляторная серная кислота (по ГОСТ 667-73) и дистиллированная вода (по ГОСТ 6709-72). Данный раствор используется во всех типах современных свинцово-кислотных аккумуляторов.
Главная характеристика электролита — плотность. Для нормальной работы АКБ плотность электролита должна лежать в пределах 1,23-1,4 г/куб. см, так как именно при такой плотности раствор имеет максимальную электропроводность. Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой.
Плотность электролита в значительной степени зависит от двух параметров: температуры и степени заряда аккумулятора.
О зависимости плотности электролита в зависимости от заряда АКБ мы сказали выше: при заряде плотность повышается, при разряде — понижается. Зависимость плотности электролита от температуры простая: при снижении температуры плотность падает, при повышении — возрастает. Поэтому нормальная плотность определяет при температуре +25°C, а чтобы верно измерять плотность при любой температуре, используют таблицу поправок к показаниям ареометра:
| Температура электролита, °C |
Поправка к показаниям ареометра, г/куб. см |
|---|---|
| -55 … -41 | -0,05 |
| -40 … -26 | -0,04 |
| -25 … -11 | -0,03 |
| -10 … +4 | -0,02 |
| +5 … +19 | -0,01 |
| +20 … +30 | 0 |
| +31 … +45 | +0,01 |
| +46 … +60 | +0,02 |
Например, если электролит при температуре +25°C имеет плотность 1,28 г/куб. см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см.
Чтобы компенсировать изменение плотности электролита в АКБ транспортных средств, эксплуатируемых в различных климатических поясах, применяются электролиты большей или меньшей плотности:
- Летние и для жаркого климата — плотностью 1,23-1,24 г/куб.см;
- Для умеренного и холодного климата — 1,27-1,28 г/куб.см;
- Зимние и для холодного климата — 1,3-1,34 г/куб.см.
Кроме того, при повышении плотности электролита повышается его морозоустойчивость — более плотные электролиты устойчивы к замерзанию, поэтому они лучше подходят для эксплуатации в холодное время года и в холодных климатических поясах.
Сегодня можно купить электролит необходимой плотности, освободив себя от непростой процедуры приготовления правильного по характеристикам электролита из кислоты и воды. Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем.
Использование аккумуляторного электролита
Сразу нужно отметить, что электролит не используется для текущего обслуживания аккумулятора. Наиболее часто в АКБ снижается уровень электролита и падает его уровень, в этом случае обслуживание выполняется добавлением воды. Дело в том, что в процессе работы аккумулятора из электролита испаряется вода, а кислота остается на месте. Также потеря воды может возникать в случае перезаряда аккумулятора — при достижении определенной плотности концентрация серной кислоты в электролите снижается и ее уже не хватает для нормального протекания указанных выше электролитических реакций. В этих условиях начинается процесс электрохимического разложения воды на водород и кислород — это проявляется «кипением» электролита, а образовавшиеся газы улетучиваются. В обоих случаях — при испарении и разложении воды — плотность электролита повышается, для ее восстановления необходимо использовать воду.
Наиболее часто электролит применяется для восстановления работы аккумулятора в случае замерзания электролита с последующей потерей его характеристик. Если электролит в АКБ замерз, то, прежде всего, необходимо занести его в теплое помещение и дождаться оттаивания. После этого аккумулятор следует поставить на зарядку с малым током — рекомендуется ток около 1 ампера и срок зарядки до 2 суток. В ходе зарядки нужно измерять плотность электролита, если она начнет повышаться, то его можно нормально зарядить и эксплуатировать.
Если же ни при каких условиях плотность не повышается, то следует произвести замену электролита. Это выполняется следующим образом:
- Слить электролит из всех банок батареи;
- Промыть банки дистиллированной водой;
- Добавить новый электролит до указанного уровня;
- Оставить аккумулятор на 2-3 часа для пропитки пластин электролитов;
- Зарядить АКБ малым током 0,5-1 ампер в течение 2 суток.
Зарядку следует остановить, когда плотность электролита и напряжение на клеммах будут стабильными в течение хотя бы двух часов.
Но если замерзание аккумулятора вызвало деформацию или разрушение пластин, то менять электролит уже бесполезно — нужно покупать новую батарею.
Аналогично устраняются и другие проблемы с аккумулятором — утечка или загрязнение электролита, ремонт АКБ после короткого замыкания и т.д. Но в этих случаях прежде нужно проверить аккумулятор на целостность и ремонтопригодность, при обнаружении трещин и других физических повреждений батарея ремонту не подлежит, ее нужно утилизировать.
Особый случай — ввод в эксплуатацию сухозаряженных аккумуляторов, которые поставляются без электролита. Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно!
Во всех случаях необходимо правильно рассчитывать объем электролита, чтобы сделать правильную покупку. Объем электролита в АКБ зависит от его напряжения и электрической емкости. Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки.
Утилизация кислот, основ, электролита. — Сайт Компании «Экологические Инвестиции»
Кислотами называются жидкие химические соединения, применяемые во время технологических процессов, изготовления различных приборов, как сырье или средство изготовления дальнейшей продукции. Процесс утилизации более актуален именно для неорганических кислот, поскольку эту категорию составляют такие их виды: серная, соляная, сероводородная, угольная, азотная, хлористая, борная, фтороводородная. Конечно, самый большой источник непригодной для дальнейшего использования кислоты – это химическая промышленность, производство аккумуляторов, текстильная, кожевная, нефтяная и другие индустрии.
Щелочи являются не менее опасными химическими веществами, нежели кислоты. Последствиями неправильного обращения со щелочью могут быть ожоги, отравления, испарения в атмосферу. Поэтому обязательным правилом для каждой организации, которая работает в сфере производства каучуков, искусственных волокон, мыла, красителей, бытовой химии, сельскохозяйственной, строительной и химической отраслей, является обращение в специализированную организацию по утилизации опасных отходов.
Электролит – это суперионное наполнение аккумуляторов в виде серной кислоты или купоросного масла, которые имеют отличную электрическую проводимость. Отходы электролита могут значительно отличаться по крепости и чистоте такой высокотоксичной жидкости. Под купоросным маслом часто подразумеваются более темные (грязные) виды серной кислоты, представленные техническими сортами – коричневый электролит. Все виды электролита крайне опасны, могут оказывать непоправимые последствия после контактом с ними, потому что их составляют оксиды, соли, кислоты, полимеры и щелочи. Используются электролиты как в жидком, так и в твердом виде – в аккумуляторах, батарейках, для очистки и получения металлов, для процессов анодирования и никелирования.
Используются электролиты как в жидком, так и в твердом виде – в аккумуляторах, батарейках, для очистки и получения металлов, для процессов анодирования и никелирования.
В связи с особой токсичностью приведенных видов отходов, наша компания, «Экологические Инвестиции» предоставляет услуги по утилизации:
- кислоты;
- щелочи;
- электролита, купоросного масла.
Отправка опасных грузов
Воздушный кодекс Российской Федерации
Статья 113. Воздушная перевозка опасных грузов
Воздушная перевозка оружия, боевых припасов, взрывчатых веществ, отравляющих, легковоспламеняющихся, радиоактивных и других опасных предметов и веществ осуществляется в соответствии с законодательством Российской Федерации, федеральными авиационными правилами, а также международными договорами Российской Федерации.
Все подробные правила, необходимые для безопасной перевозки опасных грузов по воздуху, содержатся в утвержденных Советом ИКАО документе «Технические инструкции по безопасной перевозке опасных грузов по воздуху» (Doc 9284 AN/905).
В этом документе, вещества (включая смеси и растворы) и изделия, в зависимости от вида опасности, которыми они характеризуются, подразделены на 9 классов опасности. Некоторые из этих классов подразделяются на категории.
Класс 1. Взрывчатые вещества
Категория 1.1. Вещества и изделия, которые характеризуются опасностью взрыва массой. Пример: тротил, ТЭН, нитроглицерин, аммонал, гранитол.
Категория 1.2. Вещества и изделия, которые характеризуются опасностью разбрызгивания, но не создают опасности взрыва массой.
Пример: гранаты ручные, ракеты, снаряды, боеприпасы, шнур детонирующий, детонаторы, капсюли-детонаторы, бомбы авиационные, торпеды, мины.
Категория 1.3. Вещества и изделия, которые характеризуются опасностью загорания, а также либо незначительной опасностью взрыва, либо незначительной опасностью разбрасывания, либо тем и другим, но не характеризуются опасностью взрыва массой.
Пример: порох, пороховые ускорители, твердотопливные ракеты, фейерверки, пиротехнические составы, шнур огнепроводный.
Категория 1.4. Вещества и изделия, которые не представляют значительной опасности.
Пример: патроны стрелковые, заряды промышленные, патроны строительные, пиропатроны, капсюли.
Категория 1.5. Вещества очень низкой чувствительности, которые характеризуются опасностью взрыва массой.
Категория 1.6. Изделия чрезвычайно низкой чувствительности, которые не характеризуются опасностью взрыва массой.
Класс 2. Газы
Категория 2.1. Легковоспламеняющие газы.
Пример: газовые зажигалки, сжатые и сжиженные газы в баллонах, либо сосудах Дьюара: водород, пропан, бутан, лаки и дезодоранты в аэрозольной упаковке.
Категория 2.2 Невоспламеняющиеся нетоксические газы.
Пример: сжатые и сниженные охлажденные газы в баллонах, либо сосудах
Дьюара: воздух, углекислый газ, азот кислород.
Категория 2.3 Токсические газы.
Пример: хлор, иприт.
Класс 3. Легковоспламеняющиеся жидкости
Пример: бензин, керосин, растворители, ацетон, дихлорэтан, лаки, краски масленные, нироэмали, грунтовки, полиграфические краски, чернила для принтеров, политуры, сиккативы, смывки, сольвенты, ароматизаторы для напитков на спиртной основе,настойки, герметики, эфиры, клеи на основе органических растворителей, лосьены косметические, одеколоны, духи, туалетная вода, лаки для ногтей, масло пихтовое
Класс 4. Легковоспламеняющиеся твердые вещества; вещества, подверженные самовозгоранию; вещества, выделяющие легковоспламеняющиеся газы при взаимодействии с водой
Легковоспламеняющиеся твердые вещества; вещества, подверженные самовозгоранию; вещества, выделяющие легковоспламеняющиеся газы при взаимодействии с водой
Категория 4.1. Легковоспламеняющиеся твердые вещества, самореагирующие и подобные им вещества и десенсибилизированные взрывчатые вещества.
Пример: любые металлические порошки, алюминиевый порошок с покрытием, магний, спички, «бенгальские огни».
Категория 4.2. Вещества способные к самовозгоранию.
Пример: белый или желтый фосфор, напалм, рыбная мука, уголь, уголь активированный, хлопок.
Категория 4.3. Вещества, выделяющие легковоспламеняющиеся газы при соприкосновении с водой.
Пример: карбил кальция, натрий, алюминиевый порошок без покрытия,
Класс 5. Окисляющие вещества и органические перекиси
Категория 5.1.
Окисляющие вещества.
Пример: амиачно-нитратное удобрение, амиачная селитра, калиевая селитра, хлорат кальция, отбеливатели, перекись водорода.
Категория 5.2. Органические перекиси.
Пример: гидроперекись третбутила, компоненты белой краски, некоторые отвердители.
Класс 7. Радиоактивные материалы
Пример: изотопы для целей диагностики и лечения, головки дефектоскопов, тарировочные источники, приборы гамма каротажа
Класс 8. Коррозионные вещества
Пример: аккумуляторы, электролиты для аккумуляторов, серная, соляная, уксусная и другие кислоты, пищевые кислоты, концентраты напитков, фруктовые эссенции, эдкий натр, едкое кали, ртуть, тест — системы лабораторные.
Класс 9. Прочие опасные вещества и изделия
Пример: асбест, чесночный соус, спасательные плоты, двигатели внутреннего сгорания, газонокосилки, мини-тракторы, мотоциклы, скутеры, лодочные моторы, снегоходы, гидроциклы, автомобили, пищевые добавки, экстракты, литиевые батареи, полимерные гранулы, двуокись углерода твердая(сухой лед), намагниченный материал, магнетроны, неэкранированные постоянные магниты без установленных якорей, акустические колонки эстрадной звукоусилительной аппаратуры, изделия и вещества, издающие резкий запах.
Перед тем, как предложить какое-либо грузовое место или внешнюю упаковку с опасными грузами к перевозке по воздуху, грузоотправитель обязан убедиться в том, что:
- изделия и вещества не запрещены к перевозке по воздуху;
- грузы должным образом классифицированы, упакованы, маркированы и снабжены знаками;
- документ перевозки опасных грузов надлежащим образом оформлен и подписана декларация грузоотправителя на опасные грузы.
Опасный груз допускается к воздушной перевозке только с разрешения руководителей авиационных предприятий. О предъявлении опасного груза к перевозке отправитель обязан не позднее чем через 48 ч. до ввоза груза в аэропорт подать заявление.
- При сдаче к перевозке опасного груза отправитель обязан выполнять все требования перевозчика, относящиеся к соблюдению правил перевозки опасного груза, его упаковки, маркировки, документального оформления, а также обеспечения безопасности перевозки, предусмотренные специальными правилами перевозки опасного груза, изложенными в «Технических инструкциях по безопасной перевозке опасных грузов по воздуху» ИКАО.

- Отправитель обязан предоставить перевозчику необходимые для безопасной перевозки опасного груза крепежные и пожарные средства, нейтрализующие материалы и т.п.
- Тара (упаковка) опасного груза должна соответствовать требованиям, установленным действующими стандартами и правилами перевозки опасного груза. Совместная упаковка в одну тару опасного груза с каким-либо грузом запрещается.
- Места (ящики, барабаны, баллоны и др.) с ядовитыми веществами, сжатыми и сжиженными газами отправитель обязан пломбировать. Сверху и на одной из сторон упаковки каждого места отправитель обязан наклеить ярлык специальной маркировки.
- Перевозка опасного груза производится прямыми рейсами, без перегрузок. Прием к перевозке опасного груза с перегрузками в промежуточных аэропортах категорически запрещается.
Лица, занимающиеся отправкой опасных грузов, обязаны пройти обучение и иметь соответствующий Сертификат.
В целях предотвращения погрузки опасных грузов на воздушное судно ниже приводится перечень наименований грузов, в отношении которых необходимо подтверждение содержимого грузовых мест, поскольку они могут содержать ОПАСНЫЕ грузы:
Автомобили, автомобильные части, (машина, мотор, мотоцикл). Могут содержать двигатели, карбюраторы или топливные баки, в которых находится или находилось топливо, жидкостные батареи, сжатые газы в устройствах заполнения пневматиков газом, а также огнетушители, пневмоподушки, аэрозольные упаковки со смазочными, сервисными, лакокрасочными материалами и т. д.
Могут содержать двигатели, карбюраторы или топливные баки, в которых находится или находилось топливо, жидкостные батареи, сжатые газы в устройствах заполнения пневматиков газом, а также огнетушители, пневмоподушки, аэрозольные упаковки со смазочными, сервисными, лакокрасочными материалами и т. д.
Аппаратура искусственного дыхания. Может содержать баллоны со сжатыми газами, генераторы кислорода, охлажденный сжиженный кислород.
Аппараты с электродвигателями — кресла-каталки, газонокосилки, электрокары и т. д. Могут включать жидкостные аккумуляторные батареи.
Аэрозоли. При изменении давления в самолете на высоте, может быть вытекание содержимого или взрыв баллончиков.
Аэростат, заполняемый горячим воздухом. Может содержать емкости (баллоны) с легковоспламеняющимися жидкостями или газами, огнетушители, батареи, двигатели внутреннего сгорания, сигнальные пиротехнические устройства, спасательные жилеты.
Баллоны, металлические емкости (бочки, фляги). Могут содержать сжатые или сжиженные газы, топливо, растворители, краски.
Могут содержать сжатые или сжиженные газы, топливо, растворители, краски.
Буровое оборудование, географическое оборудование, оборудование для горных работ. Может содержать взрывчатые вещества и другие опасные грузы.
Бытовые принадлежности, домашняя утварь, багаж пассажиров. Могут содержать легковоспламеняющиеся хозяйственные жидкости, коррозионные вещества для чистки кухонных плит, токсические вещества для борьбы с бытовыми насекомыми, легковоспламеняющийся газ или жидкие заправочные элементы для зажигалок, баллоны для туристических плиток, спички, отбеливающие составы, аэрозоли.
Вакцины. Могут быть упакованными с использованием сухого льда (твердая двуокись углерода).
Водолазное снаряжение. Может содержать баллоны со сжатыми газами, подводные лампы, двигатели внутреннего сгорания, аккумуляторы, сигнальные пиротехнические устройства, спасательные жилеты.
Выключатели электрического оборудования или приборов.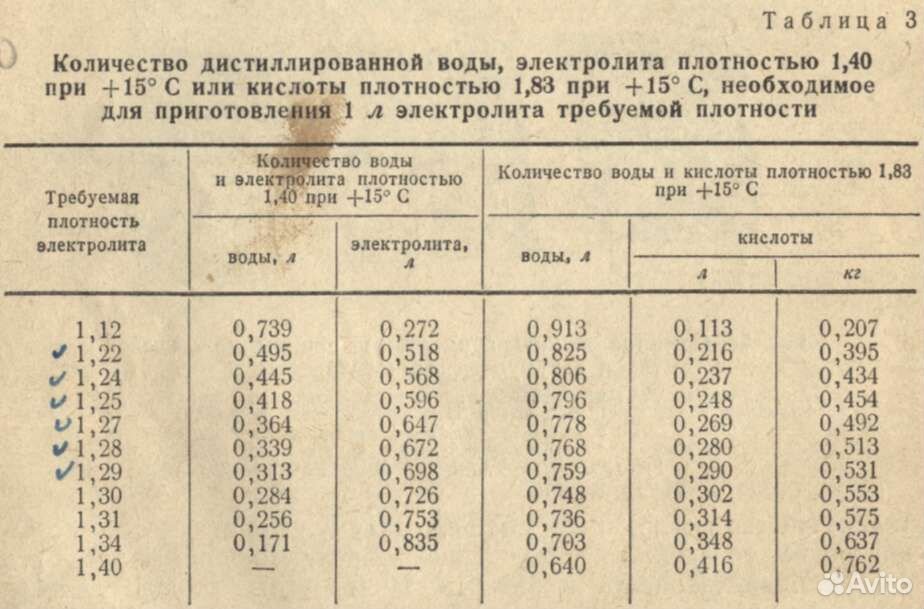 Могут содержать ртуть.
Могут содержать ртуть.
Газовые зажигалки, жидкость для зажигалок. При низком атмосферном давлении возможна утечка газа, появляется возможность взрыва.
Детали машин. Могут содержать легковоспламеняющиеся герметики, клеи, растворители, жидкостные или литиевые батареи, ртуть, баллоны со сжиженными газами.
Диагностические пробы, образцы для тестирования, лабораторное оборудование. Могут содержать любое опасное вещество, в том числе инфекционное. Замороженные фрукты, овощи. Могут быть упакованы с использованием сухого льда (твердая двуокись углерода).
Замороженные эмбрионы. Могут быть упакованы в охлажденный сжиженный газ или с использованием сухого льда (твердая двуокись углерода).
Запчасти для воздушного судна, находящегося на земле. Могут содержать взрывчатые вещества (светящиеся или прочие пиротехнические), химические генераторы кислорода, неисправные пневматики в сборе, баллоны со сжатым газом (кислород, двуокись углерода или огнетушители), топливо в оборудовании, жидкостные или литиевые батареи, спички.
Имущество гоночной (спортивной), туристической, спасательной команды. Может содержать набор аэрозолей, топливных добавок, аккумуляторов, сигнальных пиротехнических устройств, спасательных жилетов, жидкостей и сжиженных газов для туристических газовых плиток, примусов и т. д.
Инструменты (барометры, манометры, ртутные выключатели, выпрямительные лампы, термометры и т. д.). Могут содержать ртуть.
Краска — в большинстве своем, легковоспламеняющиеся жидкости, в эту категорию относятся эмали, лаки, полироли, загустители.
Медицинские препараты, фармацевтика. Могут включать инфекционные вещества, легковоспламеняющиеся жидкости, окислители, органические перекиси или коррозионные вещества.
Наборы инструментов. Могут содержать строительные пистолеты с патронами, сжатые газы, аэрозоли, легковоспламеняющиеся клеи, краски, коррозионные вещества.
Ртуть. Выделяет токсичные пары при высоких температурах и низком давлении. Легко проникает в алюминий, отчего тот становится очень слабым и ломким.
Легко проникает в алюминий, отчего тот становится очень слабым и ломким.
Станки, оборудование. Могут содержать химикаты, очищающие растворители, краску.
Сценическое, театральное оборудование. Могут содержать пиротехнические устройства, фейерверки, сухой лед «сценический дым».
Ремонтные комплекты. Могут содержать органические перекиси и легковоспламеняющиеся клеи, краски, основанные на растворителях, смолы и т. д.
Фармацевтические препараты. Могут содержать элементы, включаемые по какому-либо критерию в категорию опасных грузов, в частности радиоактивный материал, легковоспламеняющиеся жидкости, токсические и коррозионные вещества.
Фотопринадлежности. Могут содержать элементы, включаемые по какому-либо критерию в категорию опасных грузов, в частности устройства, выделяющие тепло, легковоспламеняющиеся жидкости, легковоспламеняющиеся твердые вещества, окислители, органические перекиси, токсические или коррозионные вещества.
Химические вещества для бассейнов. Могут содержать окисляющие или коррозионные вещества.
Хозяйственные принадлежности. Могут содержать предметы, включаемые по какому-либо критерию в категорию опасных грузов, например, легковоспламеняющиеся жидкости, такие как краска, основанная на растворителях, клеи, полировальные материалы, аэрозоли, отбеливающие материалы, средства очистки печей или водосточных труб от ржавчины, боеприпасы, спички и т. д.
Холодильники. Могут содержать сжиженные газы или раствор аммиака.
Экспедиционное оборудование. Может включать взрывчатые вещества (сигнальные ракеты) легковоспламеняющиеся жидкости (газолин), легковоспламеняющийся газ (газ, используемый в туристических целях) или другие опасные грузы.
Электрическое оборудование. Может содержать намагниченные материалы, ртуть в устройстве включения, электронные лампы или жидкостные батареи.
Ящики для инструмента. Могут содержать взрывчатые вещества (пистонные заклепки), сжатые газы или аэрозоли, легковоспламеняющиеся газы (баллоны с бутаном или горелки), легковоспламеняющиеся клеи и/или краски, коррозионные жидкости и т. д.
Какая кислота содержится в аккумуляторах
Знать, какая кислота в аккумуляторе автомобиля, обязан каждый водитель, самостоятельно обслуживающий своё транспортное средство. Этот вопрос вызван не праздным любопытством, имеющим цель расширить кругозор. Применяя знания такого рода на практике, можно не только продлить срок службы аккумуляторной батареи, но и избежать возникновения неприятных, а подчас и опасных ситуаций, в которые рискует попасть неподготовленный человек.
Для чего нужна кислота
Прежде чем приступать к описанию процессов, протекающих при разряде/заряде, стоит сразу сказать, какая кислота используется в аккумуляторе любого автомобиля – это серная (h3SO4), а не соляная или, например, фосфорная.
Она необходима для приготовления электролита – жидкости, в которой присутствуют заряженные частицы – ионы. Электролит представляет собой не просто пассивный раствор, в котором частицы воды и кислоты перемешаны друг с другом. Это активная жидкость, отличительная особенность которой – постоянное протекание в ней взаимно исключающих друг друга процессов – диссоциации и ассоциации.
В аккумуляторе присутствует серная кислота
При диссоциации, которая протекает лишь в водном растворе h3SO4. Молекулы кислоты образуют ионы с положительными и отрицательными зарядами:
Диссоциация кислоты
Параллельно с диссоциацией протекает обратный процесс – превращение ионов в молекулы кислоты. Полной ионизации электролита, а также полной нейтрализации заряженных частиц не происходит. Процессы находятся в динамическом равновесии, которое может измениться лишь под влиянием внешнего воздействия.
Именно наличие ионов и превращает раствор в электролит. Под влиянием электрического поля (во время зарядки) заряженные частицы переносят заряд к пластинам аккумулятора. При реакции между ионами и веществом пластин происходит высвобождение электронов. Они способны двигаться по проводнику при подключении его к электродам (их выводам).
Основные процессы, протекающие при разряде
Отрицательные пластины АКБ и их обмазка изготовлены из свинца (Pb), а у положительных активная масса имеет основой его диоксид (PbO2). Металлический свинец обладает большим количеством свободных электронов, чем его диоксид. Если положительную и отрицательную пластины соединить проводником, то разность потенциалов практически сразу уравновесится и электрический ток не возникнет.
Но если эти пластины погрузить в сернокислотный электролит, то перенос электронов вызовет химические реакции окисления металлического свинца и восстановления его диоксида:
PbO2 + SO42- + 4H++ 2e- = PbSO4 + h3O
Как видите, «конечными продуктами» этих реакций являются:
- Сульфат свинца PbSO4, образующийся на поверхности пластин.
- Вода.
- Свободные электроны (e-), благодаря которым и возникает электрический ток.
При достаточно продолжительном разряде серная кислота может полностью «израсходоваться» на образование сульфата и воды, в результате чего прекратятся химические реакции и свободные электроны не будут образовываться. Поэтому особенно ценным в плане практического использования свинцовых аккумуляторных батарей является возможность протекания обратных реакций при подключении к выводам электрического напряжения.
При зарядке сульфат свинца, прореагировав с водородом, снова становится серной кислотой, в результате чего плотность электролита восстанавливается, а поверхность пластин аккумулятора приобретает первоначальный состав.
Проверка плотности электролита
Состав электролита
Химический состав раствора прост – 35% серной кислоты + 65% воды. Такое соотношение обусловлено как необходимостью сохранить работоспособность батареи при низких температурах (до -65 С). А также избежать чрезмерной коррозии пластин – серная кислота очень агрессивна.
Разумеется, вода должна быть дистиллированной, а кислота соответствовать по чистоте ГОСТ 667-73, устанавливающему минимальные нормы содержания примесей.
При обслуживании аккумуляторов состав аккумуляторной кислоты оценивается по плотности, измеряемой ареометром. При температуре воздуха +20 С её значение должно быть 1,28 г/см3.
Но для автомобилистов необходимость самостоятельно изготавливать электролит для батареи практически отпадает. В автомагазинах продаётся как готовый раствор (плотностью 1,28 г/см3), так и корректирующий (1,4 г/см3). Также можно купить и дистиллированную воду – при необходимости её доливки.
Контроль за состоянием электролита
В первую очередь, на что должен обращать внимание владелец при уходе за батареей – это уровень электролита. Пластины должны быть полностью погружены в раствор. Расстояние от поверхности жидкости до верхнего края пластин – около 10-15 мм.
Знать, сколько жидкости должно быть в аккумуляторе, нужно лишь в тех случаях, когда вы собираетесь её поменять целиком. Объём электролита зависит от ёмкости АКБ, примерные его значения приведены в таблице:
Но замена электролита потребует слива отработанного раствора. Для чего потребуется сверлить корпус батареи и затем восстанавливать его целостность. Опрокидыванием выливать ни в коем случае нельзя. Шлаком, скопившемся на дне, можно спровоцировать замыкание пластин и окончательный выход АКБ из строя.
Поэтому уход за батареей, который имеет практическую значимость, сводится к возобновлению уровня электролита и контролю его плотности.
Практически все владельцы личного транспортного средства прекрасно знают о том, что в аккумуляторах есть кислота. Даже новички, которые только начинают постигать азы вождения, и то осведомлены касательно этого вопроса.
Многие из них слышали о кислотно-свинцовых аккумуляторах, но на деле так и не имеют представления, как именно работает это устройство. А между тем здесь протекают определенные химические реакции.
Какая кислота в аккумуляторе и для чего нужна
Большинство автомобилистов прекрасно знают, какая кислота залита в аккумуляторе. Но находятся и те, кто считают, что внутри аккумулятора ничего кроме дистиллированной воды (или дистиллята) нет. Другие же придерживаются мнения в пользу соляной кислоты, которое также неверно.
В любой автомобильной батарее содержится серная кислота — H2SO4. Если быть точнее, то речь идет о растворе серной кислоты с дистиллированной водой. Такая жидкость имеет общее название – электролит. Так какова роль серной кислоты?
Это основной компонент для работы АКБ. В отсутствие кислоты невозможен процесс заряда и разряда батареи. Это одна из самых активных разновидностей, которая способна вступать во взаимодействие практически с любым металлом, включая их оксиды. К тому же кислота может вступать в реакции обмена, а ее активность зависит от содержания воды.
Когда происходит заряд кислотного аккумулятора, пластины из чистого свинца (отрицательные) начинаются выделять электроны, которые принимаются решетками из оксида свинца (положительные). При разряде батареи происходит в точности до наоборот. Иными словами, когда пластины отдают электроны, они как бы «разрушаются» – происходит заряд, а при разряде они возвращаются обратно, что именуется «восстановлением».
И вот как раз для такого процесса разрушения – восстановления и нужна агрессивная среда в виде разбавленной серной кислоты. И без нее эффективность автомобильных батарей была бы на очень низком уровне.
Состав электролита и как правильно сделать
Серная кислота широко используется в современной промышленности для получения электрической энергии (аккумуляторы, батареи, электрические конденсаторы). Что касается состава электролита в АКБ, то соотношение между серной кислотой и дистиллированной водой следующее:
- сама кислота – 30%;
- дистиллированная вода – 70%.
Именно такая субстанция эффективным образом взаимодействует со свинцовыми пластинами. При этом особого внимания заслуживает плотность электролита, на что непосредственным образом оказывает влияние серная кислота. У концентрированной она достигает показателя в 1,83 г/см 3 . Добавлением дистиллированной воды обеспечивается понижение плотности до нужных пределов – обычно это диапазон 1,23-1,27 г/см 3 .
| Плотность электролита (г/см3) | Напряжение без нагрузки (В) | Напряжение с нагрузкой (В) | Степень заряженности (%) | Замерзание электролита (С) |
|---|---|---|---|---|
| 1,27 | 12,66 | 10,8 | 100 | -60 |
| 1,26 | 12,6 | 10,66 | 94 | -55 |
| 1,25 | 12,54 | 10,5 | 87,5 | -50 |
| 1,24 | 12,48 | 10,34 | 81 | -46 |
| 1,23 | 12,42 | 10,2 | 75 | -42 |
| 1,22 | 12,36 | 10,06 | 69 | -37 |
| 1,21 | 12,3 | 9,9 | 62,5 | -32 |
| 1,2 | 12,24 | 9,74 | 56 | -27 |
| 1,19 | 12,18 | 9,6 | 50 | -24 |
| 1,18 | 12,12 | 9,46 | 44 | -18 |
| 1,17 | 12,06 | 9,3 | 37,5 | -16 |
| 1,16 | 12 | 9,14 | 31 | -14 |
| 1,15 | 11,94 | 9 | 25 | -13 |
| 1,14 | 11,88 | 8,84 | 19 | -11 |
| 1,13 | 11,82 | 8,68 | 12,56 | -9 |
| 1,12 | 11,76 | 8,54 | 6 | -8 |
| 1,11 | 11,7 | 8,4 | 0,0 | -7 |
Знать этот параметр необходимо для понимания порога замерзания электролита. При плотности в 1,11 г/см 3 субстанция замерзает уже под воздействием относительно небольшого холод: -7 °C. У рекомендованных значений порог этот существенно отличен – от -58 °C до -64 °C. А можно ли самому сделать электролит?
Да, это действительно возможно, только действовать необходимо с предельной осторожностью. И поскольку предстоит иметь дело с серной кислотой высокой концентрации, то такая работа представляет определенную опасность. Необходимо позаботиться о защите рук, тела, органов дыхания.
Собственно в том, чтобы самостоятельно приготовить электролит для АКБ, нет ничего сложного – смешать серную кислоту с дистиллированной водой, соблюдая пропорцию. Стоит заметить, что обычна вода из-под крана для таких целей не подходит, поскольку содержит большое количество разных примесей, которые негативным образом воздействуют на свинцовые пластины.
Собственно сами ингредиенты:
- Серная кислота (плотность должна быть 1,83 г/см 3 или более, но не менее).
- Дистиллированная вода.
- Любая фарфоровая посуда.
Пропорции кислоты и воды нам известны – 30% и 70% соответственно. При этом важен характер подхода к производству – оптимально кислоту добавлять в воду, а не наоборот. Также стоит учесть, что при их смешивании будет выделяться очень много тепловой энергии и по этой причине недопустимо использовать стеклянную посуду – она просто лопается. Когда температура электролита упадет, его можно перелить в стеклянную емкость или тару из пластика.
После того как жидкости будут соединены, следует замерить плотность ареометром. Если показатели соответствуют допустимому пределу, электролит готов к эксплуатации. Но такое приспособление имеется далеко не у каждого водителя, а поэтому пригодится следующая подсказка плотности электролита (из расчета на 1 литр дистиллированной воды):
- при 1,23г/см 3 – 280г;
- при 1,25г/см 3 – 310г;
- при 1,27г/см 3 – 345 г;
- при 1,29г/см 3 – 385 г.
Собственно на этом работа и заканчивается. Тем, кто проживает в средней полосе России, следует придерживаться плотности – 1,27 г/см 3 . При этом для зон с холодным климатом (до -30 °С) допустимый показатель составляет 1,26-1,28 г/см 3 , а жарких субтропических районов – 1,24-1,26 г/см 3 . Пределы плотности от 1,27 г/см 3 до 1,29 г/см 3 актуальны для тех регионов, где зима свирепствует до -50 °С.
К чему приведет нарушение рецептуры
Показатель в 1,29 г/см 3 является не самым высоким – встречается концентрат электролита с плотностью 1,33 г/см 3 (применяется для корректировки), ранее можно было найти даже с плотность 1,4 г/см 3 , но сейчас он снят с продажи. Однако его все же следует также разбавить водой и только после этого заливать внутрь АКБ. Почему же нельзя лить сильно концентрированный электролит?
Ничего хорошо уж точно не произойдет! Из-за высокой концентрации страдают пластины аккумулятора – их просто разъедает со временем. Это происходит медленно, но верно! Поэтому, если залить высокий концентрат, не следует удивляться тому, что АКБ в скором времени вышла из строя.
Низкая плотность электролита приводит к такому явлению, которое называется сульфатацией. Об этом процессе известно многим опытным водителям. В результате на пластинах оседают кристаллы сульфита свинца, из-за чего металл утрачивает способность к накоплению заряда.
К тому же, как выше уже было упомянуто, из-за слишком низких показателей плотности электролит замерзает, обращаясь в лед. Чем это грозит, каждому уже понятно – повреждения пластин не избежать.
Как корректировать плотность жидкости
Владельцам автомобилей необходимо контролировать уровень электролита и его плотность. Из-за гидролиза и нагрева АКБ в подкапотном пространстве содержание субстанции понижается, а плотность наоборот растет. По этой причине возникает необходимость доливать дистиллированную воду. Но иногда показатели плотности электролита могут стать меньше нормы. Тогда следует поднять концентрацию кислоты.
Существуют несколько способов как это можно сделать, исходя из степени понижения плотности электролита. Для этого следует замерить его концентрацию в каждой банке по отдельности. Если густота электролита получена от 1,18 г/см 3 до 1,20 г/см 3 , то оптимальное решение – замена части электролита в банке на новый с плотностью 1,27 г/см 3 . Иными словами делается повышение плотности электролита.
Только предварительно стоит убедиться в том, что АКБ заряжена, иначе батарею следует подзарядить. При низком заряде аккумулятора к такой процедуре нельзя приступать. Иначе концентрация H2SO4 резко поднимется, что приведет только к разрушению пластин.
Сама же процедура выполняется в следующем порядке:
- Резиновой грушей откачивает как можно больше жидкости из банки. При этом замерить объем.
- Добавляют новый корректирующую жидкость с плотностью 1,27-1,29 гр/см3 в количестве равном половине изъятого объема.
- Пусть все перемешается между собой – для этого можно дать нагрузку на выводы, просто подождать некоторое время или потрясти АКБ.
- Замеряют плотность. Если показатели по-прежнему не достигли допустимых пределов доливку электролита стоит продолжать до достижения нужных параметров.
- Когда предел установлен, банки закрывают, а сам аккумулятор ставится на зарядку.
В том случае, когда плотность электролита снижена ниже уровня в 1,2 гр/см3, тогда необходимо менять его полностью – сливать старый, заливать новый.
Длительный срок службы АКБ во многом зависит от состояния залитого электролита. Последний представляет собой кислотно-водный раствор. Чтобы контролировать его качество надо знать и какая кислота в аккумуляторе автомобиля, и её свойства. Это может пригодиться при покупке сухозаряженных источников питания, когда надо самостоятельно определяться с заливаемой жидкостью. Но особенно этот вопрос актуален для районов с экстремальными климатическими условиями.
Название и роль кислоты электролита
Источник энергии фактически является стандартной батареей. Внутри её находятся анод и катод, а также аккумуляторная жидкость или электролит. Последний представлен раствором кислоты с дистиллированной водой в процентном соотношении 30 к 70, соответственно. Такая пропорция компонентов обеспечивает наиболее эффективное взаимодействие жидкости со свинцовыми пластинами.
Обычная вода содержит примеси, уменьшающие срок службы батареи. А какая кислота в аккумуляторе автомобиля обеспечит появление тока? Та, что вступает в реакции обмена с разными металлами и оксидами, которые необходимы для функционирования батареи. Самым активным из подобных веществ является триоксид серы или ангидрид с химической формулой h3SO4. Более известное и распространённое среди обывателей название — серная кислота.
Когда подключается внешняя нагрузка, тогда взаимодействие жидкости со свинцом и оксидами приводит к необходимым окислительно-восстановительным реакциям. Они противоположны при заряде и разряде батареи. Ток возникает за счёт выделения электронов из свинца положительного элемента, которые принимает оксид отрицательной пластины. А передача заряженных частиц осуществляется благодаря действию раствора, который заливается в батарею.
Основные процессы, протекающие при разряде
На контактах АКБ происходят следующие химические процессы:
- на катоде восстанавливается оксид свинца;
- тратится триоксид серы;
- появляется вода;
- на аноде образуется окись металла.
Получается, что во время реакции кислоту заменяет более лёгкая вода. В результате плотность аккумуляторной жидкости падает. При заряде процессы идут в обратном направлении. После этого под действием возникающего тока начинается электролиз, то есть распад на водород и кислород. Происходит их выделение в газообразной форме. Из-за этого раствор начинает кипеть, так как активно выходят распавшиеся компоненты. Вещества покидают состав смеси, не возвращаясь обратно. Плотность электролита повышается, так как оставшаяся кислота более тяжёлая. Чтобы восстановить первоначальные свойства приходится доливать дистиллированную воду.
Электролит и его характеристики
Параметры растворов определяют потери энергии и даже условия эксплуатации машин, то есть рабочую температуру. Нормативно характеристики регулируются стандартом ГОСТ 667-73. В большей степени физико-химические свойства зависят от пропорций содержащихся компонентов. Плотность раствора определяется соотношением кислоты и воды. Именно она является самым важным свойством электролитов для аккумуляторов. Эта величина должна укладываться в пределы от 1,07 до 1,3 г/мл. Изменение концентрации кислоты поднимает или снижает порог замерзания. От неё же зависит электрическая проводимость, которая обратно пропорциональна сопротивлению АКБ. Обледенение ведёт к повреждению и полному разрыву банок в автомобильных аккумуляторах. При низких температурах плотность рабочей смеси рекомендуется повышать до 1,31 г/см³. С точки зрения электропроводности, это не самый лучший показатель. Но уменьшение может вызвать замерзание жидкости. Оптимальная величина с минимальным сопротивлением соответствует комнатной температуре и составляет 1,23 г/см³. Какую кислотность выбирать для идеального баланса между потерями энергии и соответствия конкретным климатическим условиям описано в таблице.
Температура и рекомендуемая плотность
| Среднемесячная температура, 0С | Время года | Плотность электролита, г/см³ |
| от -50 до -30 | зима | 1,28 |
| от -50 до -30 | лето | 1,24 |
| от -30 до -15 | круглый год | 1,27 |
| от -15 до -8 | круглый год | 1,24 |
| от -8 до +4 | круглый год | 1,20 |
| от -15 до +4 | круглый год | 1,22 |
Таблица 1. Зависимость плотности электролита от температуры зимой и летом.
Изменение плотности раствора
Если снизить кислотность можно добавлением воды, то с увеличением так не получится. Плотность жидкости, залитой в аккумулятор, регулируется степенью заряженности батареи. Чем вторая величина выше, тем больше первая. Это объясняется тем, что по окончании окислительных и восстановительных реакций нередко происходит распад воды на составляющие в газообразном состоянии. То есть она теряется, а повышается концентрация кислоты в электролите. С помощью заряда избавляются от недостатка плотности. Если же и это не помогает — используют корректирующий электролит.
Соотношение заряда и плотности электролита
| Плотность при 25°С, г/см. куб. | Степень заряженности, % |
| 1,27 | 100 |
| 1,23 | 75 |
| 1,21 | 62,5 |
| 1,19 | 50 |
| 1,15 | 25 |
| 1,13 | 12,56 |
| 1,12 | 6 |
| 1,11 |
Таблица 2. Зависимость плотности электролита от величины заряда аккумуляторной батареи.
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Константа диссоциации кислоты (Ka): иногда известная как константа ионизации кислоты или просто кислотная константа — это количественно выраженная сила кислоты в водном растворе. С одной стороны, когда pH или «мощность водорода» определяют уровень основности или, в этом случае, кислотность любого раствора, константа диссоциации кислоты говорит нам о концентрации ионов водорода [H +] или ионов гидрония [h4O +] в растворе.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
pKa = -log10Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
Суперкислота. Суперкислота — это просто кислота с уровнем кислотности более 100% -ной серной кислоты с функцией кислотности Гаммета ниже -12. В более технических терминах его можно определить как среду, в которой химический потенциал протона выше, чем в чистой серной кислоте.
8. Серная кислота
Серная кислота (98%) на листе бумагиХимическая формула: H2SO4
pKa значение: -3
Ho значение: 12
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Химическая формула: HCl
pK A значение: -5,9
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифторметансульфоновая кислотаХимическая формула: CF 3 SO 3 H
pK A значение: -14,7
Трифторметансульфоновая кислота, наиболее известная как трифликовая кислота, была впервые синтезирована / обнаружена Робертом Хазелдином, британским химиком, еще в 1954 году. Она известна своей замечательной химической и термической стабильностью. В то время как другие сильные кислоты, такие как азотная и хлорная кислоты, подвержены окислению, трифликовая кислота — нет.
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
Химическая формула: HSO 3 F
H O значение: -15.1
pK A значение: -10
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Химическая формула: HClO 4
pK A значение: -10, -15.2
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислотыХимическая формула: H (CHB 11 F 11)
H o значение: -18
pK a значение: -20
Карборановые кислоты являются одной из самых сильных групп суперкислот, известных человеку, немногие из которых, как считается, имеют значение функции кислотности Гамметта, равное -18, что более чем в миллион раз выше уровня кислотности, чем чистая (100%) серная кислота.
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
Химическая формула: FSO 3 H · SbF 5
H o значение: -23
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Химическая формула: H 2 FSbF 6
H o значение: -15 (в чистом виде), -28 (с> 50 мол.%)
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Следите за New-Science.ru на нашем канале Telegram, и на странице Вконтакте. Не пропустите ни одной нашей статьи и обновления, касающиеся аэрокосмической отрасли, науки и освоения космоса.Почему соляная кислота часто продается в концентрации 33%?
Почему соляная кислота часто продается в концентрации 33%? — Обмен химического стекаСеть обмена стеков
Сеть Stack Exchange состоит из 178 сообществ вопросов и ответов, включая Stack Overflow, крупнейшее и пользующееся наибольшим доверием онлайн-сообщество, где разработчики могут учиться, делиться своими знаниями и строить свою карьеру.
Посетить Stack Exchange- 0
- +0
- Авторизоваться Подписаться
Chemistry Stack Exchange — это сайт вопросов и ответов для ученых, преподавателей, преподавателей и студентов в области химии.Регистрация займет всего минуту.
Зарегистрируйтесь, чтобы присоединиться к этому сообществуКто угодно может задать вопрос
Кто угодно может ответить
Лучшие ответы голосуются и поднимаются наверх
Спросил
Просмотрено 3к раз
$ \ begingroup $Каковы исторические перспективы выбора 33% концентрации, которая часто встречается при коммерческих продажах соляной кислоты?
Это та же самая причина, по которой мы находим, что серная кислота продается с 37% и азотной кислотой с 68%?
Я предполагаю, что это некий предел, при котором дальнейшее концентрирование, синтез или очистка достигают химического или экономического предела, но мне любопытно узнать о конкретных выбранных количествах.Очевидно, что все они также продаются с более высокой чистотой / концентрациями в качестве аналитических реагентов, но, очевидно, для производства требуется больше усилий и будет дороже.
Мелани Шебель ♦6,2999 золотых знаков4242 серебряных знака8080 бронзовых знаков
Создан 28 июн.
КаллеМП63655 серебряных знаков2020 бронзовых знаков
$ \ endgroup $ 1 $ \ begingroup $Пользователь ssavec побудил меня продолжить исследование и опубликовать ответ.
Кажется, ограничения практические.
- Для соляной кислоты — $ \ ce {HCl} $ практический предел составляет 38% с абсолютным ограничение около $ 40 ~ \% $ и коммерческие концентрации от 30 до 35% для удобства в транспортной инфраструктуре.
- Для азотной кислоты — $ \ ce {HNO3} $ предел $ 68 ~ \% $ — это максимум, который может быть достигается прямой перегонкой, более высокая концентрация до 98 $ ~ \% $ (дымящая азотная кислота) требует альтернативных методов обезвоживания или синтеза.
- Для серной кислоты — $ \ ce {h3SO4} $, которая может быть дистиллирована до $ 98,3 ~ \% $ (и может использоваться для концентрирования азотной кислоты) он продается в концентрациях, которые непосредственно подходит для предполагаемого использования в диапазоне от $ 20 ~ \% $ до $ 80 ~ \% $. С концентрациями около 30 ~ \% $, обычными для приготовления электролита свинцово-кислотных аккумуляторов.
Таким образом, кажется, что все ограничения практичны, но по разным причинам один был близок к абсолютному пределу для эффективного транспорта. Второй был на пределе прямой перегонки, а последний — для наиболее популярных потребительских приложений.
Разброс в числах заставил меня задуматься об их соотношении, но, похоже, не было прямой связи с концентрациями, которые мы наблюдаем для потребительских продаж.
Мелани Шебель ♦6,2999 золотых знаков4242 серебряных знака8080 бронзовых знаков
Создан 28 июн.
КаллеМП63655 серебряных знаков2020 бронзовых знаков
$ \ endgroup $ 1 $ \ begingroup $Принятый ответ на самом деле не объясняет, почему HCl не продается выше 40%, и комментарии к нему не совсем правильные.Возможны концентрации выше 40% по весу, но скорость испарения такого раствора при комнатной температуре / атмосферном давлении настолько высока, что концентрация быстро упадет до ниже 40%. Если требуется концентрация выше 40%, необходимо использовать специальные меры (обычно герметичный контейнер) для ее поддержания.
Создан 13 авг.
TomTom15111 серебряный знак22 бронзовых знака
$ \ endgroup $ Chemistry Stack Exchange лучше всего работает с включенным JavaScriptВаша конфиденциальность
Нажимая «Принять все файлы cookie», вы соглашаетесь с тем, что Stack Exchange может хранить файлы cookie на вашем устройстве и раскрывать информацию в соответствии с нашей Политикой в отношении файлов cookie.
Принимать все файлы cookie Настроить параметры
Какие химические вещества используются в батареях?
Для сборки батареи требуются определенные детали, состоящие из металлов и химикатов, которые влияют на стоимость батарей.
Давайте обсудим основные химические вещества, участвующие в производстве батареи:
a) Корпус батареи: Основная идея герметизации батареи корпусом батареи состоит в том, чтобы сохранить корпус батареи, который является основным источником преобразования химической энергии в электрическую. Этот кожух изготавливается слоями, созданными из различного сырья, и может включать один или два, например, слоя полиэтилентерефталата, слоя полипропилена и слоя полимера или слоев карбонизированного пластика.
b) Химический состав батареи: Чтобы выполнять свою основную функцию генерации тока для питания различных устройств, батарея должна содержать различные типы химической основы, которые различаются в зависимости от типа батареи:
и. Никель-кадмиевые батареи с использованием никеля и кадмия для длительного срока службы, расширенного температурного диапазона и высокой скорости разряда.
ii. Углеродно-цинковая батарея: Углеродно-цинковая батарея содержит диоксид марганца в качестве катода, цинк в качестве анода и хлорид цинка или хлорид аммония в качестве электролита.
iii. Свинцово-кислотные батареи: Свинцово-кислотные батареи содержат: диоксид свинца и металлический свинец в качестве анода и серную кислоту (электролит)
iv. Литий-ионные батареи: в батареях этого типа могут использоваться различные вещества, однако лучшая комбинация — это углерод в качестве анода и оксид лития-кобальта в качестве катода.
v. Многоразовые щелочные батареи: анод представляет собой цинковый порошок, а катод — из смеси диоксида марганца. Батарея получила свое название от электролита гидроксида калия, который представляет собой растворимое вещество.
c) Электролит батареи: Электролит — это среда, которая позволяет электронам течь между двумя электродами (анодом и катодом). Электролит — это проводящий химикат, состоящий из соли, основания или кислоты, растворенных в растворителе, образуя раствор, который становится проводником электричества. К химическим веществам, которые являются электролитами, относятся: хлорид натрия, хлорная кислота, азотная кислота, нитрат калия, соляная кислота, нитрат калия, серная кислота, гидроксид натрия, гидроксид магния и ацетат натрия.
См. Также:
Металлы, используемые в батареях
Электролит батареи
Разница между соляной и серной кислотами
Серная и соляная / соляная кислоты — две сильные минеральные кислоты, которые широко используются в химических лабораториях. По массе серная кислота — самый крупный продукт химической промышленности США. Годовое производство соляной кислоты далеко не так велико, но она также является ключевым промышленным химическим веществом.
Состав
Соляная кислота и серная кислота — очень разные химические соединения. Соляная кислота имеет формулу HCl, а серная кислота имеет формулу h3SO4. Это означает, что молекулы серной кислоты имеют два атома водорода, один атом серы и четыре атома кислорода, в то время как молекулы соляной кислоты имеют один атом водорода и один атом хлора. Чистая серная кислота (то есть без воды) при нагревании выделяет пары, потому что часть h3SO4 разлагается с образованием воды и триоксида серы.
Характеристики
При комнатной температуре в отсутствие воды чистая серная кислота является маслянистой жидкостью, а чистый хлористый водород — газом. Оба соединения довольно легко растворяются в воде, и обычно, покупая кислоту, вы покупаете водный раствор химического вещества. Серная кислота может отдавать два иона водорода, а соляная кислота может отдавать только один. И соляная, и серная кислоты являются очень сильными кислотами и в концентрированном растворе приводят к очень низкому pH.
Реакционная способность
Серная кислота может действовать как окислитель, особенно когда она горячая и концентрированная, то есть она может отнимать электроны у других частиц в реакции. Соляная кислота не является окислителем, хотя ее хлорид-ион может действовать как нуклеофил, поэтому концентрированная соляная кислота может использоваться в органической химии для замены спиртовой группы атомом хлора (обычно в присутствии хлорида цинка). Сульфат-ион, напротив, обычно не действует как нуклеофил.
Прочность
Химики часто описывают силу кислоты, используя число, называемое pKa, которое равно отрицательному логарифму константы диссоциации кислоты. Константа диссоциации кислоты является мерой силы кислоты в воде. Чем отрицательнее pKa, тем сильнее кислота. Кислота, подобная серной кислоте, которая может отдавать два иона водорода, имеет две pKas. PKa1 для серной кислоты составляет -3, а pKa2 — 1,99. Для соляной кислоты pKa, напротив, составляет -7.
Серная кислота: Ответы по охране труда
Вдыхание: Примите меры для обеспечения собственной безопасности перед попыткой спасения (например,грамм. носить соответствующие средства защиты). Переместите пострадавшего на свежий воздух. Сохраняйте покой в удобном для дыхания положении. Если дыхание затруднено, обученный персонал должен дать кислород в экстренной ситуации. НЕ позволяйте жертве без надобности передвигаться. Симптомы отека легких могут проявиться позже. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Контакт с кожей: Избегать прямого контакта. При необходимости надеть химзащитную одежду.Быстро снимите зараженную одежду, обувь и изделия из кожи (например, ремешки для часов, ремни). Быстро и аккуратно промокните или удалите излишки химикатов. Немедленно промойте слегка теплой проточной водой в течение не менее 30 минут. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. Если это можно сделать безопасно, продолжайте промывание во время транспортировки в больницу. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу. Сделайте двойной пакет, запечатайте, заклейте этикетку и оставьте загрязненную одежду, обувь и изделия из кожи на месте для безопасной утилизации.
Контакт с глазами: Избегайте прямого контакта. При необходимости используйте перчатки химической защиты. Быстро и аккуратно промокните или смахните химические вещества с лица. Немедленно промойте загрязненный глаз (а) теплой, слегка проточной водой в течение не менее 30 минут, удерживая веки открытыми. При наличии контактных линз НЕ откладывайте промывку и не пытайтесь снять линзу. Можно использовать нейтральный физиологический раствор, как только он станет доступен. НЕ ПРЕРЫВАТЬ ПРОМЫВКУ. При необходимости продолжайте промывание во время транспортировки в больницу.Следите за тем, чтобы не смывать загрязненную воду в незатронутом глазу или на лице. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Проглатывание: Прополоскать рот водой пострадавшего. Если рвота происходит естественным путем, попросите пострадавшего наклониться вперед, чтобы снизить риск аспирации. Попросите потерпевшего снова прополоскать рот водой. Немедленно позвоните в токсикологический центр или к врачу. Срочно требуется лечение. Транспорт в больницу.
Комментарии по оказанию первой помощи: Некоторые из рекомендуемых здесь процедур первой помощи требуют углубленного обучения навыкам оказания первой помощи.Все процедуры первой помощи следует периодически пересматривать врач, знакомый с химическим веществом и условиями его использования на рабочем месте.
Серная кислота — обзор
3.3.15 Серная кислота
Серная кислота (H 2 SO 4 ) (историческое название масло купороса ) представляет собой неорганическое химическое вещество, которое является очень коррозионным сильным минералом. кислота, представляющая собой вязкую жидкость от бесцветной до слегка желтоватой окраски с резким эфирным вкусом, растворимую в воде при любых концентрациях.Иногда кислота может продаваться в виде темно-коричневой жидкости (краситель добавляется во время производства), чтобы предупредить покупателей об опасностях обращения с этой кислотой.
Серная кислота производится в больших количествах в мировом масштабе, причем производство химического вещества часто связано со стадией развития страны из-за большого количества процессов преобразования, в которых она используется. Серная кислота (H 2 SO 4 ) является основным сырьем, используемым в широком спектре промышленных процессов и производственных операций.Большая часть производимой серной кислоты используется в производстве фосфорных удобрений, а также для других целей, включая выщелачивание меди, производство неорганических пигментов, нефтепереработку, производство бумаги и промышленное производство органических химикатов.
Серная кислота производится из элементарной серы в трехстадийном процессе:
S + O2 → SO2
2SO2 + O2 → 2SO3
SO3 + h3O → h3SO4
Поскольку реакция серы с сухим воздухом является экзотермической, диоксид серы необходимо охладить, чтобы удалить избыточное тепло и избежать обращения реакции вспять.
Сжигание элементарной серы является основным источником диоксида серы, используемого для производства серной кислоты. Сжигание сероводорода из отходящих газов, термическое разложение отработанной серной кислоты или других серосодержащих материалов и обжиг пирита также используются в качестве источников диоксида серы. Серная кислота может производиться в промышленных масштабах либо по процессу в свинцовой камере , либо по контактному процессу с современным подходом к контактному процессу.
В контактном процессе технологические установки обычно характеризуются в зависимости от загружаемого в них сырья: (1) сжигание элементарной серы, (2) сжигание отработанной серной кислоты и сероводорода и (3) сжигание сульфида металла. сжигание руд и плавильных газов. Более конкретно, контактный процесс включает три основных операции, каждая из которых соответствует отдельной химической реакции. Сначала сера в исходном сырье окисляется (сжигается) до диоксида серы:
S + O2 → SO2
Полученный диоксид серы подается в технологическую установку (часто называемую конвертером ), где он подвергается каталитическому окислению. в триоксид серы:
2SO + 2O2 → 2SO3
Наконец, триоксид серы абсорбируется в растворе сильной серной кислоты (98%):
SO3 + h3O → h3SO4
В процессе Фраша элементарная сера плавится, фильтруется для удаления золы и распыляется под давлением в камеру сгорания, где сера сжигается в чистом воздухе, высушенном путем промывки серной кислотой 93–99% (об. / об.).Газы из камеры сгорания охлаждаются, проходя через котел-утилизатор, а затем поступают в нейтрализатор катализатора (пентоксид ванадия, V 2 O 5 ). Обычно 95% -98% (об. / Об.) Диоксида серы из камеры сгорания превращается в триоксид серы с сопутствующим большим выделением тепла. После охлаждения, опять же за счет генерации пара, газ, выходящий из конвертера, поступает в абсорбционную башню. Абсорбционная башня представляет собой насадочную колонну, в которой кислота распыляется сверху, а триоксид серы поступает снизу.Триоксид серы абсорбируется серной кислотой 98–99% (об. / Об.), Где триоксид серы соединяется с водой в кислоте и образует больше серной кислоты. Если образуется олеум (раствор несвязанного триоксида серы, растворенного в серной кислоте), триоксид серы из конвертера сначала направляется в олеумную башню, в которую подается 98% (об. / Об.) Кислоты из абсорбционной системы. Затем газы из олеумной башни перекачиваются в абсорбционную колонну, где удаляется остаточный триоксид серы. В процессе однократной абсорбции используется только один абсорбер, как следует из названия, но на многих предприятиях установлен этап двойной абсорбции.
На стадии двойной абсорбции газообразный триоксид серы, образующийся на первичных ступенях конвертера, направляется в промежуточный абсорбер, где большая часть триоксида серы удаляется с образованием серной кислоты. Оставшийся непрореагировавший диоксид серы направляется на заключительные ступени конвертера для удаления большей части оставшегося диоксида серы путем окисления до триоксида серы, откуда он направляется в конечный абсорбер для удаления оставшегося триоксида серы.
Если образуется олеум (дымящая серная кислота, просто представленная как H 2 SO 4 · SO 3 ) (смесь избыточного триоксида серы и серной кислоты), триоксид серы из конвертера переходит в олеум. башня, в которую подается 98% (об. / об.) кислоты из абсорберов.Затем газы из этой колонны перекачиваются в абсорбционную колонну, где удаляется триоксид серы. Могут быть получены олеум различной концентрации. Общие включают 20% олеума (20%, об. / Об. Триоксида серы в 80%, об. / Об. Серной кислоты, без воды), 40% олеума и 60% олеума.
Диоксид серы является основным выбросом при производстве серной кислоты и обнаруживается в основном в отходящих дымовых газах. Превращение диоксида серы в триоксид серы также является неполным во время процесса, что приводит к выбросам.Двойная абсорбция считается наилучшей доступной технологией контроля (BACT), отвечающей требованиям NSPS для диоксида серы. В дополнение к дымовым газам, небольшие количества диоксида серы выбрасываются из хранилищ и вентиляционных отверстий автоцистерн во время погрузки, из концентраторов серной кислоты и из протекающего технологического оборудования.
Кислотный туман может также выделяться из дымовых газов абсорбера при производстве серной кислоты. Очень стабильный кислотный туман образуется, когда триоксид серы реагирует с водяным паром ниже точки росы триоксида серы.Типичные устройства управления включают вертикальную трубку, вертикальную панель и горизонтальные туманоуловители с двумя подушками.
Во время производства серной кислоты осадок образуется в установке удаления диоксида углерода, используемой для абсорбции газа-растворителя. В установке используется углеводородный растворитель, который во время процесса распадается на углеводородный шлам. Этот шлам обычно сжигается на другой части процесса. При производстве серной кислоты также образуются твердые отходы, содержащие тяжелый металл ванадий, когда катализатор конвертера регенерируют или просеивают.Эти отходы отправляются стороннему поставщику для переработки. Дополнительные твердые отходы производства серной кислоты могут содержать как ванадий, так и мышьяк, в зависимости от используемого сырья, и необходимо принять меры для их правильной утилизации на свалках.
— Отдел безопасности исследований
Это руководство по безопасности содержит информацию об обычных минеральных кислотах, таких как соляная, азотная, серная и фосфорная кислоты. Он НЕ покрывает опасности фтористоводородной или хлорной кислоты.См. Специальные руководства по безопасности DRS для этих двух кислот.
Предпосылки и обзор опасностей
Минеральные кислоты — это водорастворимые кислоты, полученные из неорганических минералов. Они вызывают сильную коррозию кожи и глаз. Все концентрированные кислоты бурно реагируют с водой и основаниями, выделяя тепло.
Соляная кислота (HCl)
Концентрированная соляная кислота — это раствор около 38% или 12 М хлористого водорода (HCl) в воде. Он имеет резкий запах, разъедающий дыхательную систему и глаза.Соляная кислота не классифицируется как окислитель или восстановитель. Однако при смешивании с окислителем, таким как гипохлорит натрия (отбеливатель) или перманганат калия, он будет выделять токсичный газообразный хлор.
Как неокисляющая кислота, HCl атакует и растворяет большинство неблагородных металлов, выделяя горючий газообразный водород.
Азотная кислота (HNO
3 )Азотная кислота поставляется в виде концентрированной кислоты (68-70%, 16M), дымящей силы (> 86%) и в безводной форме (100%). Это сильный окислитель даже в довольно разбавленном виде при комнатной температуре.Он окисляет большинство органических соединений, в то время как превращается в пары азота. Безводная азотная кислота может образовывать взрывоопасные смеси практически с любыми органическими соединениями.
Наиболее часто используемая азотная кислота 68-70% -ной концентрации бурно реагирует с органическими веществами, что приводит к выделению газа и потенциальному повышению давления с последующим разрывом емкости, если емкость не вентилируется должным образом. Реакции окисления с некоторыми органическими растворителями могут привести к образованию взрывоопасных нитратов.
Азотная кислота реагирует с большинством металлов, выделяя газообразный водород или оксиды азота в зависимости от концентрации и металла.Он не растворяет золото или платину.
При смешивании азотной кислоты с соляной кислотой (царская водка) образуются коричневые пары, состоящие из токсичных оксидов азота. Перед приготовлением такого раствора прочтите руководство по безопасности для царской водки.
Азотная кислота оставляет желтые пятна на коже.
Серная кислота (H
2 SO 4 )Концентрированная серная кислота часто поставляется в виде ~ 98% (18 M). Это сильный окислитель, гигроскопичный и сильный обезвоживающий агент.Он обезвоживает материалы, изготовленные из углеводов, такие как хлопок, бумажные полотенца и дерево.
Разбавленная серная кислота реагирует с металлами, как и другие минеральные кислоты, с выделением газообразного водорода. Концентрированная серная кислота может также растворять некоторые благородные металлы, такие как медь, серебро и ртуть, с выделением диоксида серы (SO 2 ). Свинец и вольфрам не реагируют с серной кислотой.
Благодаря своей сильной окислительной и дегидратирующей способности концентрированная серная кислота бурно реагирует со многими органическими химическими веществами, что приводит к выделению газа.
Фосфорная кислота (H
3 PO 4 )Чистая ортофосфорная кислота представляет собой водорастворимое кристаллическое твердое вещество. Кислота, обычно продаваемая в виде 85% -ного водного раствора, является вязкой, нелетучей и не имеет запаха. Фосфорная кислота является более слабой кислотой и имеет меньшую реакционную способность, чем другие минеральные кислоты, о которых говорилось выше.
Безопасное обращение
- При работе с кислотами всегда используйте минимальную стандартную лабораторную одежду: туфли с закрытым носком, длинные брюки, лабораторный халат, защитные очки с боковыми щитками или защитными очками и перчатки.
- При обращении с большими количествами (> 500 мл) или когда более вероятно разбрызгивание, используйте дополнительную защиту для предотвращения контакта с кожей: защитную маску над очками для защиты от брызг, кислотостойкие перчатки с длинными манжетами, а также кислотостойкий фартук или халат.
- Всегда работайте с концентрированными кислотами в вытяжном шкафу, чтобы не вдыхать пары кислоты или выделяющиеся газы. Если возможно, работайте во вторичной защитной оболочке, чтобы локализовать разливы.
- Всегда разбавляйте, добавляя кислоту в воду, а не воду в кислоту.Добавление воды в концентрированную кислоту может вызвать бурное кипение раствора и разбрызгивание.
- Растворы размером 3 M или меньше можно обрабатывать на столе, но имейте в виду, что они все еще вызывают коррозию. По возможности работайте во вторичной защитной оболочке.
Экстренные процедуры
Случайное воздействие
Контакт с кожей
Снимите загрязненную одежду и немедленно промойте пораженную кожу большим количеством воды в течение 15 минут или до исчезновения боли.Если раздражение кожи заметно, обратитесь за медицинской помощью.
Контакт с глазами
Используйте средство для промывания глаз, чтобы тщательно промыть глаза в течение как минимум 15 минут, иногда приподнимая верхние и нижние веки и катая глазные яблоки. Обратитесь за медицинской помощью.
Вдыхание
Немедленно выйдите на свежий воздух. Обратитесь за медицинской помощью.
Проглатывание
Не вызывать рвоту. Прополоскать рот водой. Обратитесь за медицинской помощью.
Предоставьте медицинской бригаде паспорт безопасности кислоты.
Разливы
Немедленно удаляйте пролитую кислоту. Прежде чем работать с любой концентрированной кислотой, приготовьте комплект для сбора разливов. Мы рекомендуем твердый бикарбонат натрия или карбонат кальция для нейтрализации разливов. Также доступны коммерческие комплекты для разлива.
Сначала нейтрализуйте разлив, накрыв его кислотным нейтрализатором, а затем удалите нейтрализованный материал впитивающими подушечками или веником.
В случае большого разлива дымящей кислоты (например, концентрированной соляной кислоты) за пределами вытяжного шкафа или если утечку невозможно локализовать, немедленно эвакуируйте зону, предупредив окружающих.Закройте дверь и не допускайте людей внутрь. Немедленно позвоните в службу 911.
Хранение
Храните кислоты в кислотном шкафу, предпочтительно во вторичной защитной оболочке. Держите их подальше от оснований и химикатов, которые выделяют токсичный газ при контакте с кислотой, таких как азиды, отбеливатель, карбиды, цианиды, нитриды, сульфиды и металлы.
Азотная кислота должна храниться отдельно от органических веществ, включая уксусную кислоту.
Удаление отходов
Храните кислотные отходы отдельно от других потоков отходов и используйте вторичную изоляцию для контейнера для отходов.Проверьте раствор для отходов на наличие выделяющихся газов, прежде чем слить его в контейнер для отходов. Избыточное давление в закрытых контейнерах для отходов в прошлом приводило к сильным разрывам контейнеров. Утилизируйте отходы с помощью программы DRS по химическим отходам.
Если отработанный раствор НЕ содержит опасных металлов, рассмотрите возможность элементарной нейтрализации:
Вылейте кислотные отходы в большое количество льда (500 граммов льда на 100 мл кислоты). Нейтрализуйте смесь водным щелочным раствором, таким как 1M или 10% гидроксид натрия (NaOH) или насыщенный бикарбонат натрия (NaHCO 3 ) в воде, пока pH не станет нейтральным.Затем нейтрализованный раствор можно вылить в канализацию. Если нейтрализованная смесь содержит тяжелые металлы (например, золото, платину, свинец, хром), раствор следует промаркировать и утилизировать через систему обращения с химическими отходами.
Выбор насоса соляной кислоты для вашего проекта
Соляная кислота — это чрезвычайно едкий раствор хлористого водорода в воде. Это прозрачная и бесцветная неорганическая кислота, которая находит широкое применение в различных отраслях промышленности.Он естественным образом содержится в желудочной кислоте. Исторически его называли духами соли, соляной кислоты и acidum salis, потому что он был сделан из зеленого купороса и каменной соли, а затем из серной кислоты и поваренной соли.
В настоящее время в мировом масштабе ежегодно производится 20 миллионов тонн соляной кислоты. Используется при производстве ПВХ-пластика, полиуретана, бытовых моющих средств и пищевой промышленности.
В каких отраслях и сферах применения используется соляная кислота?
Наибольшее количество соляной кислоты используется для травления стали, кислотной обработки нефтяных скважин, при производстве хлорида кальция, в пищевой промышленности и при переработке руды.Ниже приводится краткое описание некоторых из этих применений:
- Травление стали — Травление стали — это процесс, при котором окалина и оксиды железа превращаются в растворимые соединения для удаления их со стали. Сценарии, в которых продукты должны пройти дальнейшую обработку, например производство проволоки, изделия из олова и нанесение покрытий на листы и полосы, требуют травления стали.
- Подкисление нефтяной скважины — Чтобы стимулировать и облегчить поступление газа или сырой нефти в скважину, соляная кислота используется для удаления накипи, ржавчины и нежелательных карбонатных отложений.Этот процесс обычно называют стимуляцией.
- Пищевая промышленность — Соляная кислота находит множество применений в пищевой промышленности. Основное применение — производство кукурузного сиропа с высоким содержанием фруктозы (HFCS). Около 70-75 процентов производимого КСВСФ используется в производстве безалкогольных напитков. Соляная кислота также используется в процессе подкисления костей для производства желатина и в качестве подкислителя конечных продуктов, таких как овощные соки, соусы и консервы.
Какие насосы могут перекачивать соляную кислоту и при какой температуре и вязкости?
Для перекачивания соляной кислоты при комнатной температуре лучше всего выбрать центробежный насос с магнитным приводом без уплотнения, изготовленный из пластика Kynar или полипропилена, с герметизированным рабочим колесом и слюдяным тефлоном или угольной втулкой.
В зависимости от концентрации и температуры соляная кислота может быть тяжелой. В случаях, когда удельный вес превышает 1,1, настоятельно рекомендуется использовать подрезанное рабочее колесо, чтобы предотвратить отсоединение или перегрузку двигателя.
Рис. 1: Концентрация соляной кислоты и материалы насоса
Отдельный материал или несколько материалов могут быть рассчитаны на более высокие температуры, чем может выдержать насос в целом. Важно связаться с представителем компании March, чтобы определить, подходит ли насос в целом для концентрации и температуры любого химического вещества.
Выбор подходящего насоса для соляной кислоты
Компания March Pump предлагает химические насосы, специально разработанные для работы с соляной кислотой от 5 до 200 галлонов в минуту. Однако выбор насоса во многом зависит от температуры кислоты, концентрации используемой кислоты, ее удельного веса и многих других факторов, которые следует учитывать перед выбором насоса.


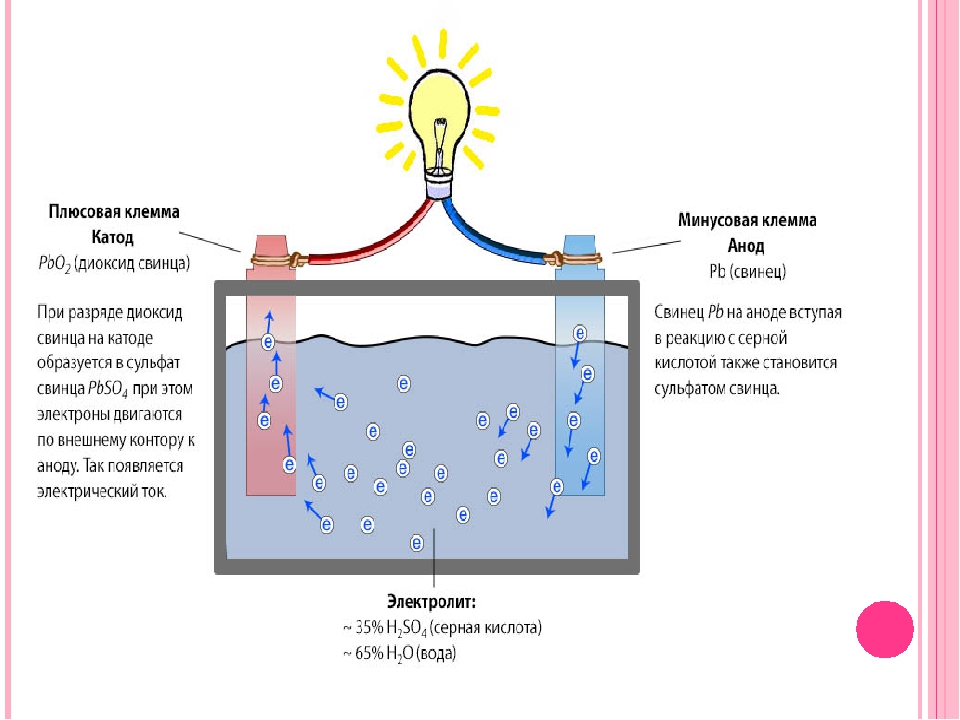 Концентрация составляет 75%, а плотность этого сорта находится в пределах 1,67 г/см 3 . Такое название он получил благодаря методу производства нитрозным способом в футерованных башнях. Обжиговый газ обрабатывается нитрозой и в процессе реакции получается кислота и оксиды азота.
Концентрация составляет 75%, а плотность этого сорта находится в пределах 1,67 г/см 3 . Такое название он получил благодаря методу производства нитрозным способом в футерованных башнях. Обжиговый газ обрабатывается нитрозой и в процессе реакции получается кислота и оксиды азота.