|
|
|
Пластиковый корпус и два контакта для подключения проводов. Именно так представляется автомобильный аккумулятор большинству из современных владельцев авто. Однако чтобы эксплуатировать его максимально эффективно, безопасно и без неожиданных сюрпризов, о батарее стоит знать немного больше. Сегодня речь пойдет о столь важной составляющей конструкции авто и мото аккумуляторов, как электролит. Он представляет собой раствор серной кислоты, которая считается, пожалуй, одним из ключевых химических соединений в мире. Это обусловлено широким спектром ее применения. Раствор серной кислоты продается под различными наименованиями, которые зависят от степени крепости, а также уровня чистоты. Приведем несколько распространенных примеров: Если говорить о максимальной крепости, получаемой способом выпаривания, то этот параметр может достигать 98,5%. Однако для заправки аккумуляторных батарей ключевое значение приобретает чистота растворов купоросного масла с химической точки зрения. Отметим также, что концентрированной серной кислотой называется совершенно прозрачная жидкость, не имеющая ни цвета, ни запаха. Она обладает консистенцию легкого масла. Ее удельный вес составляет 1б84 при температуре 15°С. В ней содержится примерно 95% серной кислоты. Концентрат может смешиваться с водой в любой пропорции. Изготавливая электролит в бытовых условиях, следует помнить, что смешивание воды и кислоты вызывает выделение значительного количества тепла. Температура кипения концентрированной серной кислоты составляет 338 градусов Цельсия. Интересным фактом из курса химии является сокращение объема раствора. Примечательно то, что при смешении двух объемов серной кислоты и воды, соответственно, их итоговый объем будет меньше, чем суммарный. Также обратите внимание на то, что удельный вес или плотность электролита авто или мото аккумулятора имеет непосредственную зависимость от тех температур, при которых работают аккумуляторы. Так, при эксплуатации в условиях низких температур нужен более плотный электролит. А в жарких странах – напротив – плотность электролита сознательно снижается. Это объясняется тем, что при таких температурах существенно повышается химическая активность раствора. В заключение отметим, что плотность электролита также зависит от того, в каких режимах эксплуатируется батарея. Так, данный параметр для тяговых аккумуляторов обычно составляет 1.26 кг\с м³ , пусковые и осветительные источники питания имеют плотность до 1.3 кг\с м³ и т.д. Для автомобильных аккумуляторных батарей эта характеристика читается нормой, когда составляет 1.28 кг\с м³ . 23.08.2013, 48591 просмотр. www.akb-market.ru Владельцы автомобилей часто задаются вопросом о том, какая кислота в аккумуляторе автомобиля, от которой зависит срок его службы. Производители этой продукции в основном заливают серную кислоту, представляющую кислотно-водный раствор определенной плотности и концентрации. Она называется электролитом, и для контроля его качества следует знать определенные особенности обращения, проверки и технические характеристики. В некоторых АКБ используется щелочной электролит, состоящий из элементов лития, натрия, калия и их комбинаций. В основном это сухозаряженные источники питания, которые применяются в суровых климатических условиях. Электролит, или серная кислота используется современной промышленностью для производства источников тока: В аккумуляторы заливается серная кислота разбавленного соотношения с водой — примерно 70% воды, 30% h3SO4. При ее отсутствии устройство не пригодно к работе. Особого внимания также заслуживает плотность жидкости, которую следует проверять и при необходимости увеличивать. Плотность в автомобильном свинцово-кислотном аккумуляторе измеряют в гр/см³, и она должна быть пропорциональна концентрации раствора с обратной зависимостью температур жидкости. Нормальный показатель — 1,27-1,29 гр/см³. Этот показатель позволяет определить состояние батареи, и если она не держит заряда, то необходимо проверить количество вещества. Со временем уровень электролита аккумулятора автомобиля сокращается, и соответственно, увеличивается плотность при гидролизе воды и нагрева. Для этого требуется периодически доливать дистиллированную воду, снижая концентрацию серной кислоты. Процедуру можно выполнить самостоятельно, если знать, сколько требуется для определенной модели вещества. Электролит для аккумуляторов можно приобрести в магазинах, либо сделать своими руками и научиться регулировать плотность, своевременно измерять и ухаживать за устройством для продления срока службы. Для приготовления потребуются следующие компоненты: Для приготовления в емкость заливается дистиллированная вода, затем серная кислота, и палочкой параллельно помешивается получаемая смесь. Процедуру проводят последовательно, так как при обратном варианте можно получить ожоги. Если места эксплуатации автотранспорта климат умеренный, то следует придерживаться такой пропорции веществ: на 1 л воды — 0,36 л кислоты. Для теплого климата на 1 л воды следует заливать кислоту в объеме 0,33 л. Полученное вещество накрывается и оставляется на сутки до образования осадков и остывания. При замене электролита в аккумуляторе надевают резиновые перчатки и очки для защиты глаз. Напомним, что при обратном проведении заливки, в частности, первой воды, возможна реакция гидратации и образования тепла в кислоте. Вероятно, что вода закипит и спровоцирует разбрызгивание. Проверять плотность аккумулятора необходимо раз в три месяца. Для этого пользуются ареометром. Без наличия в аккумуляторе электролита не будет выполняться его основная функция, так как вещество является активатором заряда и разряда. В емкости устройства жидкости должно быть много, и, соответственно, вес аккумулятора не маленький. Примерное соотношение конструкции представляет до 20 % веса жидкости, до 25 % пластика и свинцовая составляющая достигает до 80 % веса. Плюсовые пластины состоят из диоксида свинца, минусовые монолитные пластины — чистый свинец. Пластины служат для сборки пакетов, способствующих накоплению заряда. Следует отметить, что АКБ различается по моделям, и, в частности, модель 55 А/ч относится к одной из самых легких, какую можно встретить в легковых автомобилях достаточно часто. Ее вес не превышает 16 кг. Есть более компактные модели с незначительным весом, как, например, 40 А/ч и другие варианты. Если аккумулятор вышел полностью из строя, его требуется утилизировать грамотно. Но также в случае течи электролита из батареи необходимо узнать, чем нейтрализовать ее. Бывают ситуации, когда при поломке аккумулятора может быть залита отдельная часть в месте его нахождения. Для этого необходимо вытащить батарею и провести очистку. Нейтрализация этого вещества из аккумулятора, как правило, проводится при помощи специального оборудования и применения технологий. Это важно с экономической и экологической точек зрения. Если проводить неорганизованную нейтрализацию, можно нанести значительный вред окружающей среде. В настоящее время имеются два варианта нейтрализующего вещества с кислотами промышленным способом. Первый предусматривает устранение фильтрующим методом сброса кислоты в стоки, с пропусканием через магнезит, известняк и другие материалы, а второй способ – регенерация кислоты специальной обработкой с последующим получением товарного продукта. Но на практике многие водители рекомендуют в случае пролива опасного вещества использовать щелочный раствор, который делается из пищевой соды и воды. При регулярной проверке аккумулятора, в том числе контроле за плотностью и уровнем электролита, можно избежать многих проблем и продлить срок эксплуатации батареи, не допустить механических разрушений. Всегда требуется внимательно относиться к устройствам при эксплуатации, особенно в зимнее время, когда при низких температурах и сниженной плотности электролита может произойти его замерзание или разрушение пластин. batteryk.com Длительный срок службы АКБ во многом зависит от состояния залитого электролита. Последний представляет собой кислотно-водный раствор. Чтобы контролировать его качество надо знать и какая кислота в аккумуляторе автомобиля, и её свойства. Это может пригодиться при покупке сухозаряженных источников питания, когда надо самостоятельно определяться с заливаемой жидкостью. Но особенно этот вопрос актуален для районов с экстремальными климатическими условиями. Источник энергии фактически является стандартной батареей. Внутри её находятся анод и катод, а также аккумуляторная жидкость или электролит. Последний представлен раствором кислоты с дистиллированной водой в процентном соотношении 30 к 70, соответственно. Такая пропорция компонентов обеспечивает наиболее эффективное взаимодействие жидкости со свинцовыми пластинами. Обычная вода содержит примеси, уменьшающие срок службы батареи. А какая кислота в аккумуляторе автомобиля обеспечит появление тока? Та, что вступает в реакции обмена с разными металлами и оксидами, которые необходимы для функционирования батареи. Самым активным из подобных веществ является триоксид серы или ангидрид с химической формулой h3SO4. Более известное и распространённое среди обывателей название — серная кислота. Когда подключается внешняя нагрузка, тогда взаимодействие жидкости со свинцом и оксидами приводит к необходимым окислительно-восстановительным реакциям. Они противоположны при заряде и разряде батареи. Ток возникает за счёт выделения электронов из свинца положительного элемента, которые принимает оксид отрицательной пластины. А передача заряженных частиц осуществляется благодаря действию раствора, который заливается в батарею. На контактах АКБ происходят следующие химические процессы: Получается, что во время реакции кислоту заменяет более лёгкая вода. В результате плотность аккумуляторной жидкости падает. При заряде процессы идут в обратном направлении. После этого под действием возникающего тока начинается электролиз, то есть распад на водород и кислород. Происходит их выделение в газообразной форме. Из-за этого раствор начинает кипеть, так как активно выходят распавшиеся компоненты. Вещества покидают состав смеси, не возвращаясь обратно. Плотность электролита повышается, так как оставшаяся кислота более тяжёлая. Чтобы восстановить первоначальные свойства приходится доливать дистиллированную воду. Параметры растворов определяют потери энергии и даже условия эксплуатации машин, то есть рабочую температуру. Нормативно характеристики регулируются стандартом ГОСТ 667-73. В большей степени физико-химические свойства зависят от пропорций содержащихся компонентов. Плотность раствора определяется соотношением кислоты и воды. Именно она является самым важным свойством электролитов для аккумуляторов. Эта величина должна укладываться в пределы от 1,07 до 1,3 г/мл. Изменение концентрации кислоты поднимает или снижает порог замерзания. От неё же зависит электрическая проводимость, которая обратно пропорциональна сопротивлению АКБ. Обледенение ведёт к повреждению и полному разрыву банок в автомобильных аккумуляторах. При низких температурах плотность рабочей смеси рекомендуется повышать до 1,31 г/см³. С точки зрения электропроводности, это не самый лучший показатель. Но уменьшение может вызвать замерзание жидкости. Оптимальная величина с минимальным сопротивлением соответствует комнатной температуре и составляет 1,23 г/см³. Какую кислотность выбирать для идеального баланса между потерями энергии и соответствия конкретным климатическим условиям описано в таблице. Таблица 1. Зависимость плотности электролита от температуры зимой и летом. Важно! Когда используется раствор с оптимальными для определённого времени года параметрами, тогда срок эксплуатации источника питания будет значительно продлён. Дело в том, что чрезмерно концентрированная смесь, залитая в тёплое время года, негативно, даже разрушительно влияет на автомобильный аккумулятор. Высокая плотность не только увеличивает потери энергии. Серный ангидрид до такой степени активное и едкое вещество, что он способен полностью разрушить электроды. Если снизить кислотность можно добавлением воды, то с увеличением так не получится. Плотность жидкости, залитой в аккумулятор, регулируется степенью заряженности батареи. Чем вторая величина выше, тем больше первая. Это объясняется тем, что по окончании окислительных и восстановительных реакций нередко происходит распад воды на составляющие в газообразном состоянии. То есть она теряется, а повышается концентрация кислоты в электролите. С помощью заряда избавляются от недостатка плотности. Если же и это не помогает — используют корректирующий электролит. Таблица 2. Зависимость плотности электролита от величины заряда аккумуляторной батареи. Рынок предлагает огромное количество различных добавок, которые заливают в батарею для повышения качества электролита. Производители обещают улучшение запуска в морозы, увеличение срока службы, восстановление работоспособности АКБ и повышение энергоёмкости. Основное их действие — это десульфатация, но не настолько сильная, как заверяет реклама. Остальное не имеет достаточного подтверждения. Состав присадок редко раскрывают. Чаще всего это сульфаты или фосфаты металлов. Встречаются и средства из органических соединений. Причём вторые добавляют к аккумуляторной жидкости вместе с первыми. Для поддержания наилучшего состояния АКБ достаточно убирать его в период сильного похолодания в тёплое помещение или подзаряжать. Но это подойдёт, если говорить о регионах с умеренным климатом. Когда речь идёт о работе в экстремальных температурах, выгоднее может оказаться приобретение сухозаряженной батареи. Владелец сможет самостоятельно заливать электролит, максимально подходящий к условиям эксплуатации. На видео ниже показано, как из электролита получить серную и соляную кислоты. https://youtu.be/DTUom2xCh7M akkumulyatoravto.ru Осаждение железа ведут в ваннах, изготовленных из листовой стали, с пароводяной рубашкой, аналогично ваннам хромирования, но футеровку внутренней поверхности производить антег-митовыми плитками. Существующие электролиты для железнения подразделяются на: Кроме того, могут применяться борфтористоводородные, сульфаматные и прочие электролиты с различными добавками для повышения блеска, твердости и получения специальных свойств. По способу применения процессы железнения подразделяют на холодные и горячие. В холодных электролитах (20-50 °С) процесс железнения проводят при малой плотности тока. Скорость осаждения металла в этих электролитах не превышает 100-130 мкм/ч. В горячих электролитах, нагретых до 50-105 °С, электролиз протекает при высоких плотностях тока (1020 А/дм2), скорость отложения металла значительно повышается. Резкие колебания температуры при железнении в горячих электролитах могут вызвать колебания напряжений по толщине слоя осадков. Поэтому возможно растрескивание и отслаивание покрытия. При наращивании деталей нельзя допускать колебаний температуры более ±2 °С. Колебания плотности тока в меньшей степени влияют на изменение свойств покрытия, чем температура. Однако желательно, чтобы не было и значительных колебаний плотности тока. При осаждении электролитического железа необходимо избегать выключения тока. При длительной работе с перерывами тока следует перед каждым продолжением осаждения проводить анодную обработку детали в том же электролите в течение 1-2 мин при плотности тока 30-40 А/дм2. Процесс покрытия электролитическим железом осуществляют с использованием растворимых (стальных) и нерастворимых (угольных) электродов. При наращивании слоя покрытия с помощью нерастворимых электродов необходимо систематическое корректирование состава электролита по мере истощения раствора. Наибольшее применение получили хлористые электролиты, отличающиеся высокой концентрацией солей, большой скоростью наращивания железа и возможностью получения покрытий с большой толщиной. Эти электролиты получили применение на авторемонтных и других заводах для восстановления размеров на деталях, получивших большой износ. Основным компонентом хлористого электродита для железнения является хлористое железо. Хлористое железо FeCl2*4Н2О - светло-зеленые кристаллы, растворимость - свыше 600 г/л при 20 °С, молекулярная масса 198,9. При нагревании растворимость еще более возрастает. Соль легко подвергается гидролизу, и ее растворы всегда следует подкислять соляной кислотой в количествах до 0,5-0,7 г/л. При высокой концентрации хлористого железа в хлористом электролите, состоящем в основном лишь из хлористого железа, концентрацию его растворов легко определить по плотности. Для горячих хлористых электролитов разработано много вариантов с введением в их состав хлористого марганца, хлористого никеля, гипофосфита натрия и других солей. Составы и режимы осаждения железа приведены в табл. 5.3. Электролит должен быть прозрачным, иметь зеленый цвет. Фильтровать его следует не реже одного раза в 10-15 сут при работе в две смены. Твердость полученного слоя железа определяется температурой электролита и может изменяться от 100 до 400 НВ. В хлористых электролитах твердость осажденного железа возрастает с уменьшением концентрации хлористого железа и соляной кислоты, а также при увеличении катодной плотности тока и понижении температуры электролита. Температура электролита оказывает наиболее существенное влияние на твердость осажденного покрытия. Так, в хлористом электролите (400 г/л FeCl2, 10 г/л NaCl и 1 г/л НСl) при понижении его температуры всего на 10 °С твердость осадка повышается на 40-60 единиц. При дальнейшем снижении температуры до 75 °С твердость повышается до 300 НВ. При регулировании твердости покрытия за счет температуры электролита следует учитывать, что чрезмерное понижение температуры приводит к растрескиванию и скалыванию наращенного слоя. Таблица 5.3. Составы хлористых электролитов и режимы железнения. Компоненты электролита и режимы процесса Составы электролита, г/л 1 2 3 4 Хлористое железо 200-250 300-350 600-680 200-300 Хлористый марганец - - - 20-30 Хлористый натрий 100 - - - Соляная кислота - - - 0,5-1,0 Кислотность рН 0,8-1,2 0,8-1,2 0,8-1,5 - Температура электролита, °С 70-80 70-80 70-80 60-80 Плотность тока, А/дм2 20-40 20-50 20-60 30-50 Выход по току, % 85-92 85-95 85-95 90-95 Для катодного осадка электролитического железа характерны значительные внутренние напряжения. При железнении в хлористых электролитах при температуре 95 °С и плотности тока 5 А/дм2 остаточные напряжения в осажденном железе составляют примерно 150 МПа. При увеличении плотности тока до 20 А/дм2 напряжения возрастают до 370 МПа. Отпуск деталей, покрытых электролитическим железом, при температуре 500-600 °С уменьшает остаточные напряжения на 15-20 %. В электролитическом железе, полученном из хлористых электролитов при температуре 100 °С, содержится лишь 0,002-0,003 % водорода. При осаждении в сернокислых электролитах получают более хрупкие и крупнокристаллические осадки, чем в хлористых. Пластичные осадки железа в сернокислых ваннах образуются при нормальной температуре и низких плотностях тока (0,1-0,2 А/дм2). Электролитическое железо, осажденное из сернокислых растворов при 18 °С, содержит 0,085 % водорода, а твердость - 200-300 НВ. Из сернокислых электролитов, применяемых на практике, наибольшее распространение получили растворы, в которых процесс производится без нагрева электролита или при небольшом повышении температуры. Для них также необходима анодная обработка деталей перед покрытием, как это указано при осаждении железа из хлористых электролитов (табл. 5.4). Сернокислые и хлористые электролиты при повышенной температуре агрессивны к металлам оснастки ванны. Процесс наращивания элемента детали железом, упрощается при применении борфтористоводородных электролитов следующего состава (г/л) и режимов: борфтористоводородное железо - 300; борная кислота - 18; свободная борфтористоводородная кислота - 1-2; температура, °С - до 20-60; плотность тока, А/дм2 - 2-12; кислотность рН - 3,5. Таблица 5.4. Составы хлористых электролитов и режимы железнения. Компоненты электролита и режимы процесса Составы электролита, г/л 1 2 3 Сернокислое железо 180-200 3150 200-450 Сернокислый магний 40-50 - - Сернокислый натрий - 100 - Двууглекислый натрий 25-30 - - Серная кислота - 1 - Борная кислота - - 10-20 Борфтористоводородный калий - - 20-35 Кислотность рН - 2,4-2,5 1,9-2,4 Температура электролита, °С 18-20 60-70 18-25 Плотность тока, А/дм2 0,1-0,15 5-10 До 7,0 Выход по току, % - - 70-95 Таблица 5.5. Скорость осаждения железа при различных значениях плотности тока и выхода по току. Плотность тока, А/дм2 Катодный выход по току, % 90 92 94 95 1 12,0 12,3 12,5 12,7 5 60,1 61,5 62,9 63,6 10 120,0 123,0 125,2 126,8 30 360,0 369,0 375,6 380,4 50 601,0 615,0 629,0 635,0 Электролит устойчив против окисления и характеризуется хорошей рассеивающей способностью. При наличии перемешивания электролита допускается увеличение плотности тока в 1,2—1,5 раза. Скорость осаждения железа можно ориентировочно определить по табл. 5.5. ecm-zink.ru Кроме того, применяют электролит, состав которого следующий (г/л) [c.115] Гликолевый электролит. Состав электролита (в г/л) [c.178] Электролит Состав электролита Dk, а дм Температура, [c.76] В. Ф. Молчанов [626] провел испытания на усталостную прочность образцов из стали 45 диаметром 9,48 мм на машине МУИ-6000 после хромирования в саморегулирующемся электролите (состав см. в табл. 6.1). Сталь имела состав (%) 0 46 С 0,28 51 0,65 Мп 0,023 5 0,21 Р 0,14 Сг 0,15 N1. Механические свойства стали 0т=465 МН/м (47,4 кГ/мм ), 0в=723 МН/м (73,8 кГ/мм ), 05 = 22%, а1) = 40,6%. Заготовки образцов подвергались нормализации при 850°С в течение 20 мин. Всего было испытано 10 серий образцов (табл. 6.6), каждая по 6—7 образцов. Толщина покрытия во всех сериях составляла 0,05 мм, кроме серии № 5 (0,3 мм). Кривые усталости приведены на рис. 6.1. [c.260] Рецептура и режим работы ванн.. Для цинкования электродов серебряно-цинковых источников тока применяется цианистый электролит. Состав электролита и режим работы ванны следующие [c.45] Золочение в цианистом электролите. Состав цианистого электролита и режим работы следующие [c.162] Электрохимическое полирование. Электрохимическое полирование —- процесс выравнивания поверхности металла путем анодного растворения и применяется для повышения качества поверхности металлических изделий в дополнение к механическому шлифованию и полированию. Обрабатываемые детали завешиваются в ванну с электролитом в качестве анодов, катодами служат электроды из таких металлов, которые не растворяются в данном электролите. Состав электролита и режим процесса должны обеспечивать преимущественное растворение микроскопических выступов поверхности, в результате чего поверхность становится гладкой и приобретает блеск. При электрополировании решающую роль играет плотность тока, которая значительно выше, чем применяемая при осаждении металла. [c.138] Закон Фарадея может быть использован для точного определения количества электричества, проходящего в цепи постоянного тока. Для этого нужно заставить ток проходить через электролит, состав которого обеспечивает протекание одной единственной реакции хотя бы на одном из электродов. Тогда, определив количество образовавшегося продукта реакции, мы можем, пользуясь величиной электрохимического эквивалента, точно рассчитать количество прошедшего электричества. Приборы, применяемые для этой цели, называются кулонометрами. [c.52] Для стабилизации электролита по содержанию серной кислоты предложено вводить ее в виде соли трудно растворимого сернокислого стронция [1]. Избыток сернокислого стронция, находящийся в осадке, длительное время поддерживает требуемую концентрацию сернокислотного аниона в электролите. Состав электролита (г/л) хромовый ангидрид — 140—170 сернокислый стронций— 5—6. По данным работы [1], на рис. 9 приводятся сведения об интервале блестящих осадков, твердости, износостойкости и пористости покрытий, полученных из этого малоконцентрированного электролита. В табл. 1 приведены рекомендуемые режимы в зависимости от назначения покрытия. [c.12] Применение анодно-струйного способа позволяет автоматизировать процесс хромирования и значительно повысить его производительность за счет более высокого выхода по току и применения высоких плотностей тока. При этом повышается равномерность отложения хромового покрытия по толщине слоя, создаются условия для получения осадков хрома заданной толщины. Установки для анодно-струйного хромирования могут быть созданы на несколько одновременно работающих ячеек. Вариантом анодно-струйной установки является анод, который не только подает электролит к хромируемой поверхности, но и равномерно отводит его из рабочего объема через ряд сливных отверстий на поверхности анода. Этим достигается большая равномерность омывания электролитом хромируемой поверхности, способствующая более равномерному осаждению покрытия, особенно при значительных плотностях тока. Этот вариант получил название возвратно-струйного хромирования [21]. Схема такого анода для хромирования коленчатого вала приведена на рис. 39. Ячейка состоит из двух половин, охватывающих шейку коленчатого вала. В корпусе установлен анод. Электролит подается через трубу в кольцевую канавку через осевые каналы — отверстия и поступает в рабочую зону. Удаляется электролит через систему отверстий и трубу отвода. Весь агрегат для возвратно струйного хромирования, использующего холодный электролит, состо нт из следующих узлов (рис. 40) электролитическая ячейка с анодом монтируемая на хромируемой детали, емкостей для электролита анодного травления и улавливания электролита, холодильный агрегат с теплообменным аппаратом, выпрямитель и система трубопрово дов с регулирующими клапанами. Ввиду особой важности под держания постоянного уровня электролита и температуры электроли та в заданных узких пределах рекомендуется оснастить ванну хроми рования устройством для автоматического регулирования уровня электролита и температуры [12]. [c.70] Растворенная кислота НС1 переносится здесь из раствора раствор" не непосредственно, а в результате протекания двух противоположно направленных электрохимических реакций. Благодаря отсутствию диффузионных потенциалов такие цепи дают возможность точно определить коэффициент активности определенного компонента (в данном случае НС1 в электролите, состав которого можно усложнять). [c.547] Кремнефтористоводородный электролит. Состав электролита и режим работы с ним следующие [c.27] Растворимость анодных продуктов в электролите, скорость диффузии их в электролит, состав и физико-химические свойства анодной пленки имеют сушественное значение для процесса полирования. Поэтому этот процесс у различных материалов происходит неодинаково. У многих металлов и сплавов (медь, никель, алюминий, нержавеющие хромистые и хромоникелевые стали) сглаживание сопровождается появлением блеска на обработанной поверхности. У некоторых сплавов (стали карбидного класса, бронзы, латуни) наблюдается блеск без заметного сглаживания шероховатостей. Ряд металлов и сплавов (олово, свинец, серый чугун, высококремнистые стали) вовсе не полируется. Вместо сглаживания образуется сильно травленая поверхность с толстыми темными пленками. [c.111] Выбор состава электролита и режима его эксплуатации зависит от назначения покрытия и вида подготовки. Так, при отсутствии операции амальгамирования первичное покрытие серебром производят в специальном электролите, состав которого приведен на стр. 36. [c.15] Микроэлектрохимические измерения проводили в электролите, состав которого указан на с. 182. Для оценки влияния термической обработки образцы подвергали также низкотемпературному (680° С) и полному (920° С) отжигу. Установлено, что потенциал шва по отношению к основному металлу в случае сварки электродами с фтористокальциевым покрытием более отрицателен и достигает 60 мВ. В случае же сварки электродами с рутиловым покрытием разность потенциалов имеет противоположный знак и достигает 40 мВ. Отжиг практически выравнивал распределение потенциалов в обоих случаях. Распределение [c.223] В работах [42, 60] рекомендован эфирно-аммиачный электролит, состав которого следующий А1С1з б/в—130— 400 г/л, ЫПз — 8—17 г/л, диэтиловый эфир— 1 л. Электролит работает при комнатной температуре. Оптимальная плотность тока—1—3 А/дм . Электролит нуждается в предварительной электролитической проработке. Толщина покрытий достигает 50—60 мкм. Электролит корректируется добавками свежеприготовленного электролита. Основным преимуществом эфирно-аммиачного электролита является его надежная герметизация собственными парами. [c.26] Можно использовать электролит, состав которого следующий (г/л) гпси-бн о......... 60-200 [c.116] При изучении [19] изменения пластичности полуцилиндри-ческих образцов из стали А181 4340, пришли к выводу, что падение пластичности образцов, кадмированных в цианистом электролите (соста В не приводится), с ростом плотности тока уменьшается. Судя по приведенно.му диапазону плотностей тока (от 0,2 до 30 а/дм ), можно предположить, что авторы работали в перемешиваемых электролитах, хотя в самой работе указаний на это нет., В постоянно фильтруемом (а следовательно, и перемешиваемом) цианисто.м электролите кадмирования с увеличением от 0,5 до 11 а/дм наводороживание стали уменьшается [31]. Следует отметить, что уменьше- [c.166] В исходном электролите (состав, г/л 0,02 N30 0,057 МагЗО, 0,53 КагСОз 0,42 НаНСОз pH = 9) общий потенциал системы оказался равным —0,74 в. В качестве анодов функционировали цинк и алюминий. Наибольшая сила анодного тока приходилась на цинк (- 400 мка/см ). Все остальные металлы функционировали в качестве катодов с более или менее одинаковой эффективностью (30—40 мка/см ), исключение составляла платина ( 130 лг/са/сж ). Примечательно, что с введением в электролит бихромата калия общий потенциал системы сместился сильно в положительную область потенциалов (+0,005 в) и многие [c.72] Золочение в железистосинеродистом электролите. Состав желе-зистосинеродистого электролита и режим работы следующие [c.163] Электрофосфатирование алюминия на катоде можно осуществлять в электролите, состав которого указан на стр. 191. Фосфатирование ведут при рабочей температуре 18—30° С, плотности тока О = 0,1- 0,2 а дм с применением цинковых анодов. Общая кислотность раствора 18— 25 точек при величине pH 3,0—3,2. Выдержка при катодном процессе составляет 15—20 мин с дополнительной выдержкой без тока в том же растворе в течение 3—5 мин. [c.195] Электролит Состав электролита Темпера- тура, Электрическая. проводимость, СмУсм [c.46] Более надежным является электролитический метод локального выделения включений э-ш Шдиф, на котором отмечено подлежащее выделению включение (диаметром 20—50 мкм), фиксируют с помощью пластилина на предметном стекле под микроскопом, располагая в центре поля зрения Микропипеткой с изогнутым кончиком, укрепленной в прайом манипуляторе, в намеченную на шлифе зону вносят электролит, состав которого [c.69] Змачения Дприсутствии анионных органических веществ (трилонатный электролит). Состав электролита [c.73] Метод радиоэлектрохроматографии может быть успешно применен не только для аналитических целей, но и для изучения состояния радиоизотопов в растворах. Так, наблюдая перемещение изотопа по бумажной полоске в присутствии того или иного электролита, можно судить о том, является ли он катионом или анионом в данных условиях или образует коллоиды и остается на нуле — в месте нанесения капли. Меняя электролит, состав имитирующего раствора, pH, можно установить факторы, влияющие на состояние того или иного радиоизотопа в растворе, а тем самым на его поведение при различных химических операциях. Метод радиоэлектрохроматографии, нрнменонный с этой целью в нашей лаборатории, дал хорошие результаты. [c.307] Электрохимическое полирование меди рекомендуется осуществлять в электролите, состав которого был приведен в табл. 18. Возможно полирование меди и некоторых ее сплавов (латуней) и в одной ортофосфорной кислоте уд. веса 1.5 (716 г/л Н3РО4). Однако добавление к ортофосфорной кислоте хромового ангидр1ида позволяет осуществлять процесс полирования в широких пределах плотности тока (20—70 а/дм ) и сократить время полирования до 1—3 мин. Катодами служат свинцовые пластины. Соотношение поверхностей анода и катода 1 3. [c.123] chem21.info Электролиты как химические вещества известны с древних времён. Однако большинство областей своего применения они завоевали относительно недавно. Мы обсудим самые приоритетные для промышленности области использования этих веществ и разберёмся, что же последние собой представляют и чем отличаются друг от друга. Но начнём с экскурса в историю. Самые старые известные электролиты - это соли и кислоты, открытые ещё в Древнем мире. Однако представления о строении и свойствах электролитов развивались со временем. Теории этих процессов эволюционировали, начиная с 1880 годов, когда был сделан ряд открытий, связанный с теориями свойств электролитов. Наблюдались несколько качественных скачков в теориях, описывающих механизмы взаимодействия электролитов с водой (ведь только в растворе они приобретают те свойства, благодаря которым их используют в промышленности). Сейчас мы подробно разберём несколько теорий, оказавших наибольшее влияние на развитие представлений об электролитах и их свойствах. И начнём с самой распространённой и простой теории, которую каждый из нас проходил в школе. в 1887 году шведский химик Сванте Аррениус и русско-немецкий химик Вильгельм Оствальд создали теорию электролитической диссоциации. Однако тут тоже не всё так просто. Сам Аррениус был сторонником так называемой физической теории растворов, которая не учитывала взаимодействие составляющих вещества с водой и утверждала, что в растворе существуют свободные заряженные частицы (ионы). Кстати, именно с таких позиций сегодня рассматривают электролитическую диссоциацию в школе. Поговорим всё-таки о том, что даёт эта теория и как она объясняет нам механизм взаимодействия веществ с водой. Как и у любой другой, у неё есть несколько постулатов, которые она использует: 1. При взаимодействии с водой вещество распадается на ионы (положительный - катион и отрицательный - анион). Эти частицы подвергаются гидратации: они притягивают молекулы воды, которые, кстати, заряжены с одной стороны положительно, а с другой - отрицательно (образуют диполь), в результате формируются в аквакомплексы (сольваты). 2. Процесс диссоциации обратим - то есть если вещество распалось на ионы, то под действием каких-либо факторов оно вновь может превратиться в исходное. 3. Если подключить к раствору электроды и пустить ток, то катионы начнут движение к отрицательному электроду - катоду, а анионы к положительно заряженному - аноду. Именно поэтому вещества, хорошо растворимые в воде, проводят электрический ток лучше, чем сама вода. По той же причине их назвали электролитами. 4. Степень диссоциации электролита характеризует процент вещества, подвергшегося растворению. Этот показатель зависит от свойств растворителя и самого растворённого вещества, от концентрации последнего и от внешней температуры. Вот, по сути, и все основные постулаты этой несложной теории. Ими мы будем пользоваться в этой статье для описания того, что же происходит в растворе электролита. Примеры этих соединений разберём чуть позже, а сейчас рассмотрим другую теорию. По теории электролитической диссоциации, кислота - это вещество, в растворе которого присутствует катион водорода, а основание - соединение, распадающееся в растворе на гидроксид-анион. Существует другая теория, названная именем известного химика Гилберта Льюиса. Она позволяет несколько расширить понятие кислоты и основания. По теории Льюиса, кислоты - это ионы или молекулы вещества, которые имеют свободные электронные орбитали и способны принять электрон от другой молекулы. Несложно догадаться, что основаниями будут являться такие частицы, которые способны отдать один или несколько своих электронов в "пользование" кислоте. Очень интересно здесь то, что кислотой или основанием может быть не только электролит, но и любое вещество, даже нерастворимое в воде. В 1923 году, независимо друг от друга, двое учёных - Й. Бренстед и Т. Лоури -предложили теорию, которая сейчас активно применяется учёными для описания химических процессов. Суть этой теории в том, что смысл диссоциации сводится к передаче протона от кислоты основанию. Таким образом, последнее понимается здесь как акцептор протонов. Тогда кислота является их донором. Теория также хорошо объясняет существование веществ, проявляющих свойства и кислоты и основания. Такие соединения называются амфотерными. В теории Бренстеда-Лоури для них также применяется термин амфолиты, тогда как кислота или основания принято называть протолитами. Мы подошли к следующей части статьи. Здесь мы расскажем, чем отличаются друг от друга сильные и слабые электролиты и обсудим влияние внешних факторов на их свойства. А затем уже приступим к описанию их практического применения. Каждое вещество взаимодействует с водой индивидуально. Какие-то растворяются в ней хорошо (например, поваренная соль), а какие-то совсем не растворяются (например, мел). Таким образом, все вещества делятся на сильные и слабые электролиты. Последние представляют собой вещества, плохо взаимодействующие с водой и оседающие на дне раствора. Это означает, что они имеют очень низкую степень диссоциации и высокую энергию связей, которая не позволяет при нормальных условиях распадаться молекуле на составляющие её ионы. Диссоциация слабых электролитов происходит либо очень медленно, либо при повышении температуры и концентрации этого вещества в растворе. Поговорим о сильных электролитах. К ним можно отнести все растворимые соли, а также сильные кислоты и щёлочи. Они легко распадаются на ионы и очень трудно собрать их в осадки. Ток в электролитах, кстати, проводится именно благодаря ионам, содержащимся в растворе. Поэтому лучше всех проводят ток сильные электролиты. Примеры последних: сильные кислоты, щёлочи, растворимые соли. Теперь разберёмся, как влияет изменение внешней обстановки на свойства веществ. Концентрация напрямую влияет на степень диссоциации электролита. Более того, это соотношение можно выразить математически. Закон, описывающий эту связь, называется законом разбавления Оствальда и записывается так: a = (K / c)1/2. Здесь a - это степень диссоциации (берётся в долях), К - константа диссоциации, разная для каждого вещества, а с - концентрация электролита в растворе. По этой формуле можно узнать много нового о веществе и его поведении в растворе. Но мы отклонились от темы. Кроме концентрации, на степень диссоциации также влияет температура электролита. Для большинства веществ её увеличение повышает растворимость и химическую активность. Именно этим можно объяснить протекание некоторых реакций только при повышенной температуре. При нормальных условиях они идут либо очень медленно, либо в обе стороны (такой процесс называется обратимым). Мы разобрали факторы, определяющие поведение такой системы, как раствор электролита. Сейчас перейдём к практическому применению этих, без сомнения, очень важных химических веществ. Конечно, все слышали слово "электролит" применительно к аккумуляторам. В автомобиле используют свинцово-кислотные аккумуляторы, роль электролита в котором выполняет 40-процентная серная кислота. Чтобы понять, зачем там вообще нужно это вещество, стоит разобраться в особенностях работы аккумуляторов. Так в чём принцип работы любого аккумулятора? В них происходит обратимая реакция превращения одного вещества в другое, в результате которой высвобождаются электроны. При заряде аккумулятора происходит взаимодействие веществ, которого не получается при нормальных условиях. Это можно представить как накопление электроэнергии в веществе в результате химической реакции. При разряде же начинается обратное превращение, приводящее систему к начальному состоянию. Эти два процесса вместе составляют один цикл заряда-разряда. Рассмотрим вышеизложенный процесс на конкретном примере - свинцово-кислотном аккумуляторе. Как нетрудно догадаться, этот источник тока состоит из элемента, содержащего свинец (а также диокисд свинца PbO2) и кислоты. Любой аккумулятор состоит из электродов и пространства между ними, заполненного как раз электролитом. В качестве последнего, как мы уже выяснили, в нашем примере используется серная кислота концентрацией 40 процентов. Катод такого аккумулятора делают из диоксида свинца, а анод состоит из чистого свинца. Всё это потому, что на этих двух электродах протекают разные обратимые реакции с участием ионов, на которые продиссоциировала кислота: Если читать реакции слева направо - получаем процессы, происходящие при разряде аккумулятора, а если справа налево - при заряде. В каждом химическом источнике тока эти реакции разные, но механизм их протекания в общем описывается одинаково: происходят два процесса, в одном из которых электроны "поглощаются", а в другом, наоборот, "выходят". Самое главное то, что число поглощённых электронов равно числу вышедших. Собственно, кроме аккумуляторов, существует масса применений этих веществ. Вообще, электролиты, примеры которых мы привели, - это лишь крупинка того многообразия веществ, которые объединены под этим термином. Они окружают нас везде, повсюду. Вот, например, тело человека. Думаете, там нет этих веществ? Очень ошибаетесь. Они находятся везде в нас, а самое большое количество составляют электролиты крови. К ним относятся, например, ионы железа, которые входят в состав гемоглобина и помогают транспортировать кислород к тканям нашего организма. Электролиты крови также играют ключевую роль в регуляции водно-солевого баланса и работе сердца. Эту функцию выполняют ионы калия и натрия (существует даже процесс, происходящий в клетках, который назвается калий-натриевым насосом). Любые вещества, которые вы в силах растворить хоть немного, - электролиты. И нет такой отрасли промышленности и нашей с вами жизни, где бы они ни применялись. Это не только аккумуляторы в автомобилях и батарейки. Это любое химическое и пищевое производство, военные заводы, швейные фабрики и так далее. Состав электролита, кстати, бывает разным. Так, можно выделить кислотный и щелочной электролит. Они принципиально отличаются своими свойствами: как мы уже говорили, кислоты являются донорами протонов, а щёлочи - акцепторами. Но со времением состав электролита меняется вследствие потери части вещества концентрация либо уменьшается, либо увеличивается (всё зависит от того, что теряется, вода или электролит). Мы каждый день сталкиваемся с ними, однако мало кто точно знает определение такого термина, как электролиты. Примеры конкретных веществ мы разобрали, поэтому перейдём к немного более сложным понятиям. Теперь о физике. Самое важное, что нужно понимать при изучении этой темы - как передаётся ток в электролитах. Определяющую роль в этом играют ионы. Эти заряженные частицы могут переносить заряд из одной части раствора в другую. Так, анионы стремятся всегда к положительному электроду, а катионы - к отрицательному. Таким образом, действуя на раствор электрическим током, мы разделяем заряды по разным сторонам системы. Очень интересна такая физическая характеристика, как плотность. От неё зависят многие свойства обсуждаемых нами соединений. И зачастую всплывает вопрос: "Как поднять плотность электролита?" На самом деле ответ прост: необходимо понизить содержание воды в растворе. Так как плотность электролита большей частью определяется плотностью серной кислоты, то она большей частью зависит от концентрации последней. Существует два способа осуществить задуманное. Первый достаточно простой: прокипятить электролит, содержащийся в аккумуляторе. Для этого нужно зарядить его так, чтобы температура внутри поднялась чуть выше ста градусов по цельсию. Если этот способ не помогает, не переживайте, существует ещё один: просто-напросто заменить старый электролит новым. Для этого нужно слить старый раствор, прочистить внутренности от остатков серной кислоты дистиллированной водой, а затем залить новую порцию. Как правило, качественные растворы электролита сразу имеют нужную величину концентрации. После замены можете надолго забыть о том, как поднять плотность электролита. Состав электролита во многом определяет его свойства. Такие характеристики, как электропроводность и плотность, например, сильно зависят от природы растворённого вещества и его концентрации. Существует отдельный вопрос о том, сколько электролита в аккумуляторе может быть. На самом деле его объём напрямую связан с заявленной мощностью изделия. Чем больше серной кислоты внутри аккумулятора, тем он мощнее, т. е. тем большее напряжение способен выдавать. Если вы автолюбитель или просто увлекаетесь автомобилями, то вы и сами всё понимаете. Наверняка вы даже знаете, как определить, сколько электролита в аккумуляторе находится сейчас. А если вы далеки от автомобилей, то знание свойств этих веществ, их применения и того, как они взаимодействуют друг с другом будет совсем не лишним. Зная это, вы не растеряетесь, если вас попросят сказать, какой электролит в аккумуляторе. Хотя даже если вы не автолюбитель, но у вас есть машина, то знание устройства аккумулятора будет совсем не лишним и поможет вам в ремонте. Будет гораздо легче и дешевле сделать всё самому, нежели ехать в автоцентр. А чтобы лучше изучить эту тему, мы рекомендуем почитать учебник химии для школы и вузов. Если вы хорошо знаете эту науку и прочитали достаточно учебников, лучшим вариантом будут "Химические источники тока" Варыпаева. Там изложены подробно вся теория работы аккумуляторов, различных батарей и водородных элементов. Мы подошли к концу. Подведём итоги. Выше мы разобрали всё, что касается такого понятия, как электролиты: примеры, теория строения и свойств, функции и применение. Ещё раз стоит сказать, что эти соединения составляют часть нашей жизни, без которой не могли бы существовать наши тела и все сферы промышленности. Вы помните про электролиты крови? Благодаря им мы живём. А что насчёт наших машин? С помощью этих знаний мы сможем исправить любую проблему, связанную с аккумулятором, так как теперь понимаем, как поднять плотность электролита в нём. Всё рассказать невозможно, да мы и не ставили такой цели. Ведь это далеко не всё, что можно рассказать об этих удивительных веществах. fb.ru Для работы свинцово-кислотной аккумуляторной батареи необходим электролит – водный раствор серной кислоты, обладающий высокой ионной проводимостью. При погружении электродов аккумулятора в электролит и подключении к выводам электродов внешней нагрузки начинаются электрохимические реакции, описанные в предыдущей статье. Электролит для заливки в аккумуляторную батарею готовят из серной кислоты (ГОСТ 667-73) и дистиллированной воды (ГОСТ 6709-72). При подготовке электролита следует пользоваться руководством по эксплуатации автомобиля. Для надежной работы аккумуляторных батарей необходима высокая степень чистоты электролита. Нельзя применять техническую серную кислоту и недистиллированную воду, так как при этом ускоряется саморазрядка, сульфатация и разрушение пластин, и уменьшается емкость батареи. При приготовлении электролита кислоту льют тонкой струйкой в воду, одновременно помешивая раствор чистой стеклянной палочкой. Нельзя наливать воду в кислоту, так как при этом выделяется большое количество тепла в верхних слоях раствора, и электролит будет разбрызгиваться из емкости и при попадании на тело может вызвать ожоги. Смешивать электролит следует в кислотостойкой эбонитовой, фарфоровой или освинцованной посуде. Количество дистиллированной воды, серной кислоты или электролита при приготовлении 1 литра электролита необходимой плотности приведены в таблице 1. Таблица 1. Количество дистиллированной воды, серной кислоты или электролита плотностью 1,4 г/см3 для приготовления 1 л электролита необходимой плотности при температуре 25 ˚С, л Плотность
электролита Для серной кислоты
плотностью 1,83 г/см3 Для электролита
плотностью 1,4 г/см3 дистиллированная
вода серная кислота дистиллированная
вода электролит 1,23 0,829 0,231 0,465 0,549 1,25 0,809 0,253 0,410 0,601 1,27 0,791 0,274 0,357 0,652 1,31 0,749 0,319 0,246 0,760 1,40 0,650 0,423 0 1 Плотность электролита определяют с помощью денсиметра или ареометра. Новые аккумуляторные батареи заливают электролитом плотностью на 0,02 г/см3 меньше той, которая должна быть в конце зарядки. *** Плотность электролита, как и любого другого вещества, определяется отношением массы к занимаемому этой массой объему. Для электролита плотность измеряется в граммах на кубический сантиметр (г/см3).
Поскольку плотность дистиллированной воды равна 1 г/см3, а серная кислота тяжелее воды (ее плотность при +20 ˚С составляет: 1,8312-1,8355 г/см3), то с добавлением серной кислоты в воду плотность электролита будет возрастать, а при добавлении в раствор (электролит) воды, его плотность будет уменьшаться. По этим же причинам плотность будет уменьшаться при сульфатации пластин и при сильной разрядке батареи, а увеличивается при испарении воды (например, в процессе интенсивной зарядки). При понижении плотности электролита возрастает внутреннее сопротивление аккумуляторной батареи и уменьшается ее емкость. В морозное время года чрезмерное снижение плотности может привести к замерзанию электролита. Повышение плотности электролита приводит к интенсивному разрушению пластин и их сульфатации, что снижает емкость аккумулятора и уменьшает срок его службы. Следует учитывать, что плотность электролита в аккумуляторах (банках) аккумуляторной батареи не должна отличаться более чем на 0,01 г/см3. В противном случае батарею необходимо полностью зарядить и произвести корректирование плотности электролита.
Если плотность выше нормы - доливают дистиллированную воду, если ниже - электролит плотностью 1,4 г/см3 (электролит можно доливать лишь в полностью заряженную аккумуляторную батарею). Корректировку плотности доливкой производят после предварительного отбора из аккумуляторов нужного количества электролита. После этого аккумуляторную батарею заряжают в течение 25...30 мин для полного перемешивания электролита и снова измеряют его плотность. В процессе эксплуатации необходимо следить за состоянием аккумуляторной батареи. При нормальных эксплуатационных параметрах плотность электролита в аккумуляторах батареи является индикатором степени их разрядки. Снижение плотности электролита на 0,01 г/см3 соответствует разрядке аккумулятора на 6 %.
Если появляется необходимость в частой подзарядке батареи, следует выяснить причину и ее устранить, поскольку систематическая недозарядка аккумуляторной батареи значительной сокращает срок ее службы и отрицательно сказывается на пусковых качествах двигателя. *** Степень зарядки аккумуляторной батареи проверяют измерением плотности электролита, приведенной к температуре +25 ˚С. В зависимости от климатических условий эксплуатации автомобиля и времени года используется электролит разной плотности (таблица 2). Таблица 2. Плотность электролита в зависимости от климатических условий и времени года Макрокли-
матический район Климатический район (ГОСТ 16350-80) Средне-
месячная температура воздуха в январе, ˚С Время года Плотность электролита приведенная к температуре +25 ˚С, г/см3 Для новой аккумуляторной батареи Для заряженной аккумуляторной батареи Холодный Очень холодный от -50 до -30 Зима 1,28 1,30 Лето 1,24 1,26 Холодный от -30 до -15 Круглый год 1,26 1,28 Умеренный Умеренный от -15 до -3 Круглый год 1,24 1,26 Жаркий сухой от -15 до +4 1,22 1,24 Теплый влажный 0 до +4 1,20 1,22 При определении плотности электролита необходимо учитывать его температуру, применяя соответствующие поправки, приведенные в таблице 3. Таблица 3. Поправки при измерении плотности электролита (г/см3) в зависимости от его температуры Температура электролита,
˚С +45 +30 +15 0 -30 -15 -45 Поправка плотности +0,02 +0,01 0 -0,01 -0,02 -0,03 -0,04 *** Одним из важнейших условий надежной работы аккумуляторной батареи является поддержание необходимого уровня электролита в ее элементах. Уровень электролита в каждой секции моноблока (банках) должен быть на 10…15 мм выше предохранительного щитка, установленного над сепараторами. Для облегчения контроля уровня электролита у заливных горловин аккумуляторных батарей снизу имеются указатели – тубусы, входящие внутрь аккумуляторной батареи. Нижний срез тубуса находится на требуемом расстоянии от поверхности предохранительного щитка. Уровень электролита считается достаточным, если поверхность электролита касается нижнего торца тубуса горловины. При этом на поверхности электролита образуется четко видимый мениск. Если уровень электролита ниже указанного из-за выплескивания, следует долить дистиллированной воды. Проверять уровень электролита рекомендуется на остывшей заряженной аккумуляторной батарее или после длительной поездки, так как в этом случае происходит «кипение» электролита, повышение его температуры и испарение дистиллированной воды. В случае превышения уровня электролита в банках аккумуляторной батареи его следует уменьшить с помощью резиновой груши, так как выплескивание может привести к интенсивной коррозии деталей крепления и к окислению проводов. *** Типы автомобильных аккумуляторов k-a-t.ruКакая кислота в аккумуляторе автомобиля применяется в качестве электролита? Электролит состав
состав и свойства — Информация
Какая кислота в аккумуляторе автомобиля и какова ее плотность
Состав электролита
Контроль плотности

Составляющий компонент строения АКБ
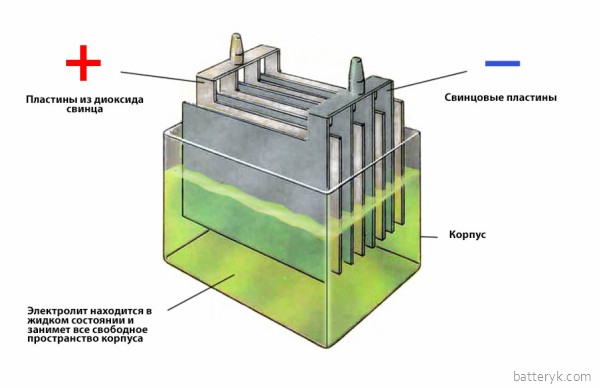
Нейтрализация электролита
Какая кислота в аккумуляторе автомобиля: состав, характеристики

Название и роль кислоты электролита
Основные процессы, протекающие при разряде
Электролит и его характеристики
Температура и рекомендуемая плотность
Среднемесячная температура, 0С Время года Плотность электролита, г/см³ от -50 до -30 зима 1,28 от -50 до -30 лето 1,24 от -30 до -15 круглый год 1,27 от -15 до -8 круглый год 1,24 от -8 до +4 круглый год 1,20 от -15 до +4 круглый год 1,22 Изменение плотности раствора
Соотношение заряда и плотности электролита
Плотность при 25°С, г/см. куб. Степень заряженности, % 1,27 100 1,23 75 1,21 62,5 1,19 50 1,15 25 1,13 12,56 1,12 6 1,11 0 Присадки
Состав электролитов железнения и его режимы

Хлористые электролиты
Сернокислые электролиты
Электролит состав - Справочник химика 21
Электролит Состав, % (масс.) Темпе- ратура начала Плотность Удельная электро- [c.236]примеры. Состав и свойства электролитов. Сильные и слабые электролиты

История
Теория электролитической диссоциации Аррениуса

Теория кислот и оснований Льюиса

Протолитическая теория Брендстеда-Лоури
Сильные и слабые электролиты
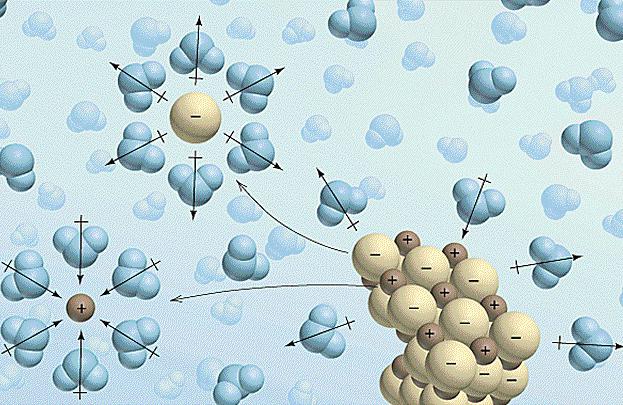
Факторы, влияющие на поведение электролитов
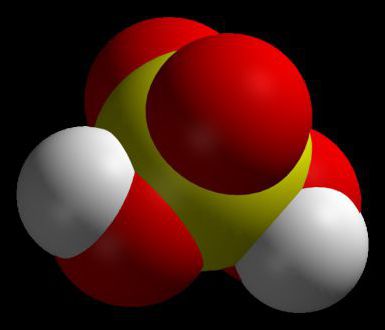
Промышленное использование

Физические свойства электролитов

Где это пригодится?
Заключение
Электролит свинцово-кислотной аккумуляторной батареи.
Электролит
Плотность электролита
Определение степени зарядки аккумуляторной батареи
Проверка уровня электролита

 Добавить сайт в избранное
Добавить сайт в избранное















.jpg)

