|
|
|
2 г. назад Получение соляной кислоты дома из серной кислоты АКБ. Электролит+соль = HCl хлороводород. Метод получения... 8 мес. назад Увеличение концентрации серной кислоты в электролите при помощи выпаривания раствора. Использование прос... 1 мес. назад Главный Механик - Зачистка и оцинковка металла. Galvanizing cars with his hands. Хлорид Цинка, Хлористый Цинк. Цинкарь,... 2 г. назад Электролиз - обзор процесса . Обзор про то как выделить и осадить золото после электро аффинажа в домашних... 2 г. назад Получение серной кислоты h3SO4 из электролита дома. Выпаривание нужно проводить в хорошо проветриваемом... 4 г. назад NaHCO3+h3SO4 35%=углекислый газ. 4 г. назад КАК СДЕЛАТЬ ПАЯЛЬНУЮ КИСЛОТУ В ДОМАШНИХ УСЛОВИЯХ Моя партнерка рекомендую! http://www.air.io/?page_id=1432&aff=1126 В контак... 3 г. назад Как получить концентрированную серную кислоту дома? Нам понадобится всего лишь сходить в автомаг, купить... 5 мес. назад Рыбы все живые растения не погибли. Не кого не призываю поступать так же!!! Делаете всё на свой страх и риск.... 8 г. назад Подписывайтесь на нашу группу Вконтакте — http://vk.com/chipidip, и Facebook — https://www.facebook.com/chipidip * Электролитами назы... 10 мес. назад Лайфхак! Унитазный камень VS КИСЛОТА! Самый простой способ вывести налёт на дне унитаза с помощью обычного... 2 г. назад СЕРНАЯ КИСЛОТА VS COCA COLA ✓Я В VK: http://vk.com/eduard.krawchenko ✓Я В Инстаграм https://www.instagram.com/ourvidostv Что будет если ... 7 мес. назад ЧЕМ нейтрализовать КИСЛОТУ в домашних условиях - это просто. достаточно взять щелочь и добавить ее в кислот... 8 мес. назад В этом выпуске я рассмотрел 4 основные проблемы потери жидкости из автомобильного аккумулятора. Что долива... 3 г. назад Черный электролит, как правило возникает ввиду естественного износа, либо не правильной эксплуатации.... 3 г. назад Что делать если замерз аккумулятор? Замени электролит стоит недорого и Всё очень просто! Ну или поиграться... 3 г. назад Нужно обязательно следить за уровнем электролита в аккумуляторе. Низкий уровень - возможен взрыв под нагру... 4 г. назад Аккумуляторы что на (((видео))) после замены єлектролита работают на отлично банки не замкнуло заменил на... 2 г. назад Иногда плотность электролита может катострафически упасть, до показателя 1,18 г/см3. Это очень мало - норма... 11 мес. назад В ролике представлен процесс анализа раствора после обработки золота смесью серной кислоты с азотной.... turprikol.com В качестве стартерных батарей в автотранспорте используются свинцово-кислотные аккумуляторы. Функционирование аккумулятора обеспечивается специальным раствором серной кислоты — электролитом. О том, что такое аккумуляторный электролит, каких типов он бывает, и как его использовать — читайте в статье. Аккумуляторный электролит — водный раствор серной кислоты, предназначенный для использования в свинцово-кислотных аккумуляторных батареях (АКБ). Электролит готовится путем растворения концентрированной серной кислоты в дистиллированной воде, молекулы кислоты в данном растворе диссоциируют (распадаются) на ионы — это явление наделяет электролит электропроводящими свойствами. Аккумуляторный электролит имеет следующее назначение: Но прежде, чем применять электролит для той или иной цели, необходимо разобраться в его характеристиках и особенностях применения. Электролит, свинцовые пластины и пористый диоксид свинца (PbO2) — три основных компонента свинцово-кислотного аккумулятора. Именно в присутствии кислотного электролита протекают электрохимические реакции, делающие возможным накопление и отдачу аккумулятором электрического заряда. Во время разряда АКБ металлический свинец и оксид свинца вступают в реакцию с серной кислотой (точнее — с ее отрицательными ионами SO4 и положительными ионами H), образуя сульфат свинца (PbSO4) и воду, при этом на анодных пластинах выделяются избыточные электроны. На катодных пластинах, напротив, наблюдается недостаток электронов, благодаря этому при замыкании анода и катода между ними возникает электрический ток. Во время заряда АКБ проходят обратные реакции — под действием тока от стороннего источника из сульфата свинца образуются чистый свинец, диоксид свинца и кислота. В ходе данных реакций количество серной кислоты и воды в электролите изменяется, что приводит к изменению его плотности и объема. При разряде АКБ концентрация кислоты понижается, а концентрация воды немного увеличивается, что приводит к падению плотности и к некоторому увеличению объема электролита. В процессе заряда плотность повышается, а объем несколько понижается. Электролит изготавливается смешиванием концентрированной серной кислоты и дистиллированной воды в строго определенных пропорциях. Для изготовления электролита используется специальная аккумуляторная серная кислота (по ГОСТ 667-73) и дистиллированная вода (по ГОСТ 6709-72). Данный раствор используется во всех типах современных свинцово-кислотных аккумуляторов. Главная характеристика электролита — плотность. Для нормальной работы АКБ плотность электролита должна лежать в пределах 1,23-1,4 г/куб. см, так как именно при такой плотности раствор имеет максимальную электропроводность. Однако плотность концентрированной серной кислоты составляет 1,83 г/куб. см, поэтому для достижения необходимой плотности кислота смешивается с водой. Плотность электролита в значительной степени зависит от двух параметров: температуры и степени заряда аккумулятора. О зависимости плотности электролита в зависимости от заряда АКБ мы сказали выше: при заряде плотность повышается, при разряде — понижается. Зависимость плотности электролита от температуры простая: при снижении температуры плотность падает, при повышении — возрастает. Поэтому нормальная плотность определяет при температуре +25°C, а чтобы верно измерять плотность при любой температуре, используют таблицу поправок к показаниям ареометра: Например, если электролит при температуре +25°C имеет плотность 1,28 г/куб. см, то при температуре -15°C он имеет плотность 1,25 г/куб. см, а при нагреве до +50°C (что часто бывает в подкапотном пространстве автомобиля) плотность повышается до 1,3 г/куб. см. Чтобы компенсировать изменение плотности электролита в АКБ транспортных средств, эксплуатируемых в различных климатических поясах, применяются электролиты большей или меньшей плотности: Кроме того, при повышении плотности электролита повышается его морозоустойчивость — более плотные электролиты устойчивы к замерзанию, поэтому они лучше подходят для эксплуатации в холодное время года и в холодных климатических поясах. Сегодня можно купить электролит необходимой плотности, освободив себя от непростой процедуры приготовления правильного по характеристикам электролита из кислоты и воды. Электролит продается в тарах емкостью от 1 до 20 литров, поэтому всегда можно приобрести нужный для работы объем. Сразу нужно отметить, что электролит не используется для текущего обслуживания аккумулятора. Наиболее часто в АКБ снижается уровень электролита и падает его уровень, в этом случае обслуживание выполняется добавлением воды. Дело в том, что в процессе работы аккумулятора из электролита испаряется вода, а кислота остается на месте. Также потеря воды может возникать в случае перезаряда аккумулятора — при достижении определенной плотности концентрация серной кислоты в электролите снижается и ее уже не хватает для нормального протекания указанных выше электролитических реакций. В этих условиях начинается процесс электрохимического разложения воды на водород и кислород — это проявляется «кипением» электролита, а образовавшиеся газы улетучиваются. В обоих случаях — при испарении и разложении воды — плотность электролита повышается, для ее восстановления необходимо использовать воду. Наиболее часто электролит применяется для восстановления работы аккумулятора в случае замерзания электролита с последующей потерей его характеристик. Если электролит в АКБ замерз, то, прежде всего, необходимо занести его в теплое помещение и дождаться оттаивания. После этого аккумулятор следует поставить на зарядку с малым током — рекомендуется ток около 1 ампера и срок зарядки до 2 суток. В ходе зарядки нужно измерять плотность электролита, если она начнет повышаться, то его можно нормально зарядить и эксплуатировать. Если же ни при каких условиях плотность не повышается, то следует произвести замену электролита. Это выполняется следующим образом: Зарядку следует остановить, когда плотность электролита и напряжение на клеммах будут стабильными в течение хотя бы двух часов. Но если замерзание аккумулятора вызвало деформацию или разрушение пластин, то менять электролит уже бесполезно — нужно покупать новую батарею. Аналогично устраняются и другие проблемы с аккумулятором — утечка или загрязнение электролита, ремонт АКБ после короткого замыкания и т.д. Но в этих случаях прежде нужно проверить аккумулятор на целостность и ремонтопригодность, при обнаружении трещин и других физических повреждений батарея ремонту не подлежит, ее нужно утилизировать. Особый случай — ввод в эксплуатацию сухозаряженных аккумуляторов, которые поставляются без электролита. Обычно для подготовки такого аккумулятора его нужно заполнить электролитом и дождаться достижения необходимой плотности — все эти действия обязательно прописаны в инструкции к аккумулятору. Предварительную зарядку сухозаряженного АКБ проводить не нужно! Во всех случаях необходимо правильно рассчитывать объем электролита, чтобы сделать правильную покупку. Объем электролита в АКБ зависит от его напряжения и электрической емкости. Наиболее распространенные 12-вольтовые аккумуляторные батареи емкостью 55-60 А·ч вмещают 2,5-3 литра, емкостью 75-90 А·ч — от 3,5 до 5 литров. Большие 24-вольтовые АКБ емкостью свыше 100 А·ч могут содержать 10 и более литров электролита. При покупке рекомендуется брать электролит с небольшим запасом, так как в процессе работы возможны непредвиденные потери и утечки. www.avtoall.ru Неопытные владельцы автомобилей, часто задают вопрос, а какая кислота в аккумуляторе автомобиля. Из-за незнания выдвигаются различные версии. Кто-то говорит – вода, кто-то считает, что там соляная кислота. Нужно наконец разобраться с этим вопросом раз и навсегда. Знайте, что в свинцово-кислотной АКБ роль электролита выполняет серная кислота. Это не концентрированная кислота, а её раствор в дистиллированной воде. Этот раствор и называется электролит. Особенности электролита в разновидностях свинцово-кислотных батареях В роли электролита в аккумуляторах могут выступать различные вещества. К примеру, щёлочь. Это вещество работает в никель-кадмиевых или никель-металлогидридных батареях. К тому же, есть отдельных группа свинцово-кислотных аккумуляторов AGM и GEL, которые называются гелевыми. В гелевых аккумуляторных батареях используется тот же раствор, но только в связанном состоянии. Кислота в GEL батареях переведена в гель с помощью оксида кремния, в случае AGM электролитом пропитано стекловолокно. Самыми распространенными на рынке являются свинцово-кислотные батареи, обозначаемые WET. Поэтому в большинстве магазинов продается электролит именно для таких АКБ. Использование серной кислоты в электролите – это только одна из сфер её применения. Она используется в самых разных отраслях. Например, с помощью strongSO4 (химическая формула серной кислоты) очищается металл перед покраской или нанесением покрытия. Также кислота используется в производстве красителей, фармакологии, взрывчатых веществ, нефтепереработки, производства удобрений. Однако наиболее широкая сфера применения – это аккумуляторы. На свинцово-кислотные аккумуляторы идёт довольно много выпускаемой strongSO4. Концентрация, используемого электролита, равна 30─35% (вес.). Вес остальной объём – это дистиллированная вода. Обычная вода из-под крана для приготовления электролита использоваться не может. В последней имеется очень много примесей. В частности солей металлов. Попадание этих примесей в аккумуляторную батарею сокращает срок её эксплуатации из-за возникновения паразитных реакций. В быту 30% концентрации для АКБ вполне хватает. А вот в производстве используется strongSO4 с высокой концентрацией. Такую кислоту получают за 2 стадии. Первая ступень – это получение концентрации около 70%. Второй этап – это доведение концентрации до 98%. Такая кислота пригодна для длительного хранения. Также получают strongSO4 с концентрацией 99%, но она постепенно снижается до значения 98,3% из-за того, что происходит потеря SO3. mygazeta.com Ребята у меня много статей про электролит в аккумуляторе. Например — почему он темнеет или сколько его внутри батареи в литрах. Но нет, ни одной статьи, которая рассказывает о его плотности, а именно о нормальном значении. А действительно, какое оно у заряженной и разряженной АКБ, от чего зависит и на что влияет. Если честно, то многие «матерые» водители знают эту информацию как «отче наш», однако с новичками все сложнее, многие вообще ни разу не заглядывали внутрь, не видели пластин, да и не представляют, из чего состоит электрохимическая жидкость. Будем это исправлять … СОДЕРЖАНИЕ СТАТЬИ Для того чтобы понять зачем нужен электролит, а тем более его плотность и что это такое вообще, стоит вспомнить строение стандартной свинцово-кислотной батареи: А вот теперь мы и подошли к самому интересному, чтобы происходила реакция между плюсовыми и минусовыми пластинами, чтобы накапливался заряд, как раз и нужна электрохимическая жидкость или попросту электролит, причем с определенной плотностью. Как я уже написал сверху это жидкость, которая состоит из специальных компонентов. Собственно их всего два – это серная кислота и дистиллированная вода. Размещены они примерно в сочетании один к двум. То есть одна массовая доля кислоты и две доли воды (если взять процентное соотношение — то 35% на 65%). Именно такое соотношение заставляет пластины (плюс и минус) накапливать заряд. Но что такое плотность? Все просто – плотность это и есть соотношение кислоты и воды, если его замерить специальным прибором (ареометром) он покажет такое значение (35/65%). Значит, соотношение правильное и не требуется корректировка. То есть не нужно добавлять ни воды, ни кислоты. Но в процентах оно практически не указывается, а измеряется граммами на сантиметр в кубе (г/см3), это говорит нам о концентрации кислоты (граммов) в одном кубическом сантиметре электролита. Если смотреть посмотреть показание ареометра, то они должны быть 1,27 – 1,29 г/см3. Это говорит нам о том, что серная кислота находится в достаточной концентрации, то есть она растворена в воде, а не осела в виде сульфатов на пластинах. Однако такая плотность считается нормальной в средней полосе России. То есть выдерживает температуры до минус 40 градусов Цельсия. Если вы используете автомобиль ближе к северу, то плотность можно немного увеличить. Ведь если она будет не достаточной, то батарея просто может замерзнуть. Так для – 40 градусов, лучше иметь электролит в концентрации 1,30 -1,35 г/см3. Также стоит помнить, что плотность очень сильно «прыгает» в зависимости от заряда и разряда аккумулятора. Почему да все просто. При заряде батарея начинает поглощать дистиллированную воду из электролита, поэтому концентрация начинает расти. Разрушаются так называемые «соли серной кислоты», которые оседают на пластинах. У полностью заряженной батареи она составляет 1,27 – 1,29 г/см3! После того как зарядка окончена, то идет разряд (допустим на пуски и прочие потребители), плотность может упасть до 1,18 г/см3 – это уже разряженный АКБ. Именно при разрядах из батареи поглощается серная кислота, она оседает на пластинах в виде сульфатов. Если батарею сильно разрядить или долго не заряжать, то пластины (этими сульфатами) просто «запечатываются», становятся очень жесткими – не способными разрушится при зарядке, именно этот процесс и называется сульфатацией. Он очень опасен, большинство АКБ «умирают», не от того что осыпались пластины и электролит стал мутный и черный, а именно из-за того что емкость упала, пластины в сульфатах. Поэтому если у вас плотность ниже чем 1,27 г/см3, это говорит что АКБ разряжен. А если она 1,15 — 1,18 – это практически глубокий разряд. Нужно срочно заряжать батарею, иначе сульфатация. Вот кстати небольшое видео об этом. Многие в качестве эксперимента, захотят повысить плотность намного выше, чем нормальный показатель. Либо вообще залить просто одну кислоту! Сделать это можно по разным причинам, например чтобы не замерзала при критических температурах. Но ребята, делать этого не нужно, это также может убить ваш АКБ. Почему? Да потому что серная кислота это очень сильный растворитель — если зальете ее концентрированную, то она разъест ваши металлические пластины, вот и все! Она запросто разъедает твердые металлы, такие как сталь, а уж о свинце и говорить нечего! Максимальная концентрация, которая возможна, примерно — 1,35 г/см3! Дальше уже не рекомендуется, потому что кислота начинает «подъедать» пластины. Я немного рассказал сверху, что низкая концентрация электролита говорит нам о разряде, и она ведет к сульфатации пластин. Это очень плохо! Еще одним минусом низкого значения, является низкой порог замерзания. Попросту ваш аккумулятор может замерзнуть, а это еще хуже. Ведь значение в 1,17 г/см3, имеет порог замерзания примерно -5, — 10 градусов Цельсия, а если «завернет» – 20! Что не редкость? Лед сломает пластины, да и корпус. После замерзания восстановить АКБ, очень сложно. Это практически 100% выход из строя АКБ. Сейчас небольшое, но полезное видео, смотрим. Собственно на этом буду заканчивать, думаю, моя статья была вам полезна. Читайте наш АВТОБЛОГ. avto-blogger.ru Автомобильные аккумуляторы извлекают электрическую энергию из химической реакции, протекающей внутри него. по сути АКБ конвертируют энергию из электрической в химическую в процессе заряда и наоборот, когда выдают необходимый ток. Для качественного протекания этих процессов требуются ингредиенты достаточной чистоты. Особенно это касается серной кислоты, вместе с дистиллированной водой являющейся тем, из чего состоит электролит в аккумуляторе. По сути то, что залито в аккумулятор — это разбавленная серная кислота. В основе работы любого свинцово-кислотного аккумулятора лежит химический процесс, высвобождающий электрический заряд. Молекулы серной кислоты расщепляют посредством электролитической диссоциации свинцовые электроды, создавая положительно и отрицательно заряженные ионы. Собираясь на положительных и отрицательных электродах батареи, ионы создают на клеммах АКБ необходимый заряд. Со временем часть молекул связывается без возможности возобновить свою работу в банках, что снижает плотность электролита. Поэтому так важно следить за концентрацией аккумуляторной кислоты. Процесс носит название электролитической диссоциации. При нём ионы с положительным зарядом(катионы) — устремляются к плюсовому электроду. К отрицательному электроду направляются анионы — отрицательно заряженные ионы. Окислителем выступает диоксид свинца, который в результате взаимодействия с молекулами кислоты восстанавливается, отдавая отрицательный заряд на электроды. Растворы серной кислоты слабо проводят электрический ток, однако хорошо справляется с ионным обменом. При разрядке АКБ положительные ионы свинца устремляются через электролит с губчатого свинца – восстановителя. Здесь происходит превращение в двухвалентный свинец из четырехвалентного, таким образом, оставляя заряд 2 электронов с каждого иона. На аноде — PbO2 + SO42− + 4H+ + 2e− -> PbSO4 + 2h3O — окисление свинца. На катоде — Pb + SO42− − 2e− ->PbSO4 Во время зарядки идут обратные реакции — свинец движется в сторону пластин. Оба электрода покрываются слоем сульфата, который образовывается из отрицательных кислотных остатков и положительных двухвалентных ионов свинца. Это называется сульфатацией, которая для пластин аккумулятора весьма опасна и грозит быстрым износом. Выделяемые газы в процессе восстановительно-окислительных реакций считаются побочным эффектом, однако они могут серьёзно повлиять на работоспособность всей батареи. В процессе разрядки батареи к отрицательно заряженному электроду устремляются электроны, где они производят нейтрализацию ионов свинца. В зависимости от уровня заряда батареи плотность электролита может иметь разное значение. Измерения делаются при комнатной температуре + 25 °С. Использование кислоты происходит в 1,6 раз больше положительными электродами. Поэтому рост объема электролита наблюдается при разрядке батареи и уменьшение – при зарядке. Свинцово — кислотные аккумуляторы для автомобилей наиболее распространенные на сегодня. Электролит в аккумуляторе автомобиля это 33-38 % раствор серной кислоты в дистиллированной воде. Плотность такого раствора примерно равна 1.27 г/л. Существует несколько стандартов качества кислоты, но нас интересует только характеристики кислоты для АКБ. Согласно ГОСТ 667 73 аккумуляторная кислота должна обладать следующими физико-химическими показателями. Для высшего сорта массовые части: Прозрачность раствора определяется при комнатной температуре жидкости с помощью специального теста. Согласно ГОСТ 667 73 кислота аккумуляторная должна быть определенной прозрачности, что при установке на поле с шахматными клетками и подсвечивании его электрической лампой должно давать четкие очертания ячеек. Представленные данные — это эталонные показатели, и на практике то что заливают в аккумулятор всегда ниже качеством и больше загрязнено. Повышение плотности электролита происходит как следствие повышения температуры и гидролиза в батарее. Для выравнивания этого показателя требуется постоянное добавление определенного количества дистиллята. При меньшей концентрации аккумуляторной кислоты в электролите, следует ее поднимать, если датчик показывает значение ниже 1,275 г на куб. см. Важно! Кислота является агрессивной средой для тканей человека, одежды. Поэтому при работах с открытой батареей следует позаботиться о мерах защиты: надеть защитные очки и резиновые перчатки. Не помешает прорезиненный фартук или старая одежда. Кислотность электролита поднимается двумя путями: внесением концентрированной кислоты с помощью постепенного разбавления или полная замена электролита новым. В первом случае следует провести такие действия для каждой банки: С помощью подобных манипуляций следует довести до нужной плотности концентрацию серной кислоты в электролите. При показателе индикатором значения плотности ниже 1,2 г на куб. см, требуется полная замена электролитической жидкости, поскольку подобным способом поднятие ее невозможно. Такой уровень в заряженном состоянии наводит на мысль о целесообразности операции. Если батарее менее года, то процедура может увенчаться успехом, более старые элементы питания, скорее всего, реанимацию не переживут. Видеоинструкция по обслуживанию аккумулятора Для приготовления нового электролита требуется концентрированная кислота для аккумуляторов, которая продается с плотностью 1,835 – 1,84 г на куб. см. Разбавляется жидкость чистой дистиллированной водой, поскольку содержащиеся соли металлов в обычной проточной воде пагубно влияют на электроды АКБ. Важно! Внесение дистиллята в кислоту строго запрещено. В результате таких действий возникает сильный нагрев, бурная реакция с разбрызгиванием вещества. Поэтому добавлять следует кислоты в дистиллированную воду тонкой струйкой. Для того чтобы развести аккумуляторную жидкость, следует проделать такие операции: Таблица плотностей электролита и соотношения дистиллята и кислоты При получении слишком концентрированной жидкости, следует провести разбавление ее дистиллятом. При смешивании дистиллированной воды и аккумуляторной кислоты в процессе реакций выделяется тепло, которое будет опасным для электродов. Поэтому заливать в банки следует только остывший раствор. Срок службы аккумуляторной батареи ограничивается ее техническими характеристиками. Однако неправильное использование и хранение может существенно снизить этот показатель. Чтобы АКБ не изнашивалась стремительно, нужно следить за плотностью электролита и его уровнем. В результате химических процессов повышение плотности раствора происходит из-за высокой температуры и естественных реакций окисления и восстановления. Поэтому следует доливать дистиллят. Сильное падение плотности требует полноценной замены электролитической жидкости. Важно соблюдать меры предосторожности при работе с емкостью, а также следовать четким инструкциям. Вконтакте Facebook Twitter Google+ akkummaster.com ХЛОРНАЯ КИСЛОТА КАК ЭЛЕКТРОЛИТ [c.157] Почему хлорная кислота наиболее удобный и часто используемый электролит для приготовления растворов с заданной ионной силой [c.226] При малых концентрациях HG1 в электролите на аноде происходит преимущественно разряд ионов ОН , доля разряда С1Г в общем токе составляет менее 50%. С увеличением концентрации HG1 в электролите до 8—10% процессы разрядки ОН , выделения кислорода и образования хлорной кислоты подавляются и на аноде происходит преимущественно разряд Gl ". Выход хлора на аноде по току приближается к 100%. [c.285] Хлорная кислота может быть получена анодным окислением растворенного электролите хлора [57]. В качестве электролита может применяться 4—6 н. раствор хлорной кислоты [65, 67]. Сообщается, что на платиновых анодах и серебряных катодах электролизеры на нагрузку 3,5 кА при плотности тока 2 кА/м и температуре О °С работали при напряжении 4 В [68]. Процесс протекает по суммарному выражению [c.429] Сообщается [7] о применении для окисления хлористого водорода или хлора в электролите — хлорной кислоте — электролизеров фильтр-прессного типа с диафрагмой из пластмассовой сетки. Рамы электролизера выполнены из поливинилхлорида, аноды из платиновой фольги и катоды из серебра. Электролизеры на нагрузку 5 кА работают при плотности тока 2,5 кА/м , напряжении на ячейке [c.429] Влияние температуры. На процесс электролиза существенно влияет температура. Понижение, температуры увеличивает выход хлорной кислоты по току, так как при этом повышается перенапряжение кислорода. Кроме того, понижение температуры увеличивает значение оптимальной концентрации соляной кислоты в электролите. На рис. 56,6 приводятся данные выхода продуктов электролиза от температуры. [c.157] Процесс электролиза следует осуществлять в слабокислом, электролите, чтобы уменьшить потери выхода по току за счет вы-деления кислорода при разряде ОН . Для снижения выделения хлора на аноде pH электролита поддерживают добавлением в электролит хлорной кислоты. При работе на анодах из РЬОг электролиз осуществляют в щелочных электролитах. Для уменьшения катодного восстановления в электролит добавляют соли хрома при работе на платиновых анодах. [c.161] Хлорная кислота как электролит 177. [c.157] Серная кислота по ряду причин является более подходящим электролитом по сравнению с хлорной. Используемый электролит предварительно очищают от примесей электролизом при потенциале, применяемом при титровании, до тех пор, пока ток в цепи не снизится до 50 мка. Содержание плутония в пробе вычисляют по разности между количествами электричества, затраченными в прямом и обратном процессах. Рабочим электродом служит сетка из платины. [c.25] Для отделения железа, меди, хрома, молибдена и никеля перед осаждением сульфата бария рекомендуется применять электролиз с ртутным катодом в слабокислой среде (стр. 165). При анализе пирита, в результате первоначальной обработки пробы обратной царской водкой (обратное соотношение между соляной и азотной кислотами по сравнению с обычно принятым) и бромом и выпаривания на паровой бане, как указано в разделе Разложение минералов, содержащих серу (стр. 794), остается достаточное для электролиза количество серной кислоты. Можно прибавить небольшое количество соляной или хлорной кислоты. Электролиз проводится при силе тока 0,8—1 а в течение 5—6 ч или при меньшей силе тока — в продолжение ночи. По окончании осаждения ополаскивают стенки сосуда и возможно полнее - сливают электролит декантацией в стакан емкостью 300 мл. Обмывают стенки сосуда для электролиза и ртуть небольшими порциями воды, которую сливают декантацией в основной раствор, и затем освобождают этот раствор от суспендированных веществ фильтрованием и промыванием остатка на фильтре. [c.797] Сплавы, содержащие 50—70% сурьмы, отличаются лучшей способностью к пайке и высокой коррозионной стойкостью. Для их получения был предложен электролит следующего состава (г/л) перхлорат висмута (в пересчете на металл) 10—11, трехфтористая сурьма (в пересчете на металл) 53-—55, хлорная кислота 300. Электролиз ведется при температуре 20° и плотности тока 0,25—1,0 а/дм . [c.254] В качестве фоновых электролитов при получении неорганических соединений обычно используются кислоты, щелочи, значительно реже соли, растворимые в воде. Типичным примером инертного в широком диапазоне потенциалов фонового электролита является хлорная кислота. В процессах получения неорганических соединений хлорная кислота используется как фоновый электролит при электрохимическом окислении молекуляр-.ного хлора и хлороводородной кислоты [c.94] Для ускорения процесса необходимо тем или иным способом препятствовать образованию пленки двуокиси свинца. При добавке к серной кислоте таких веществ, как хлорная кислота, хлорноватокислый калий, азотнокислый натрий и т. п., анионы которых дают со свинцом растворимые соли, на электроде при каждом заряде образуется значительное количество сернокислого свинца. Переход рыхлого осадка сернокислого свинца в двуокись не препятствует проникновению кислоты в глубину пластины. Введение в электролит сернистой, щавелевой, винной кислот и других восстановителей приводит к разрушению вредной пленки двуокиси свинца. [c.128] Для снижения удельного электрического сопротивления электролита и соответственно потерь напряжения в электролите электролизу подвергают разбавленные растворы соляной кислоты в растворах сильных электролитов. Наиболее удобно вести процесс окисления иона С1 до СЮг в растворах хлористого водорода или хлора в концентрированной 4—6 и. хлорной кислоте. При этом возможна организация непрерывной подачи хлористого водорода, соляной кислоты или хлора в электролит и отвода части электролита в виде концентрированной хлорной кислоты для окончательной переработки ее в готовую продукцию [15—17]. [c.83] Для уменьщения затрат, связанных с очисткой хлорной кислоты от ионов хлора, обычно применяют каскад электролизеров. При этом весь процесс окисления с получением хлорной кислоты осуществляют в две стадии. На первой, продукционной, стадии электролиз ведут при оптимальном значении концентрации НС1 или растворенного в электролите хлора и при высоком значении выхода хлорной кислоты по току. На второй, так называемой очистной, стадии прекращают подачу соляной кислоты, H I или СЬ в электролит и ведут окисление ионов хлора до остаточного содержания, определяемого требованиями потребителя хлорной кислоты. [c.85] Электролиз на очистной стадии можно проводить в периодическом режиме. Тогда выход по току и скорость очистки хлорной кислоты от ионов хлора в течение процесса электролиза будут непрерывно снижаться. Соотношение между остаточной концентрацией ионов хлора в электролите и выходом хлорной кислоты по току может быть определено по данным, приведенным на рис. 3-4. Средний выход хлорной кислоты за весь цикл электролиза на очистной стадии зависит от глубины очистки и сильно уменьшается при снижении остаточного содержания ионов хлора. [c.85] При получении хлорной кислоты путем анодного окисления хлора удается обеспечить очень высокое качество H IO4, так как с хлором в электролит не вводится никаких примесей. [c.161] Электролит представляет собой эвтектическую смесь следующего состава 40% хлорной кислоты, 2,5% перхлората магния и 57,5% дистиллированной воды. Добавка перхлората магния понижает точку плавления смеси и несколько увеличивает эффективность тока. Т кая смесь замерзает при —61 °С. Электролиз проводят при силе тока 3 а, при этом анодная плотность тока составляет —0,3 а/см . Во время электролиза под держивают температуру. примерно —50 °С и несколько ниже, охлаждая ячейку смесью сухого льда с ацетоном Температуру в ячейке измеряют пентановым термометром 3. Более высокий выход озона получается при абсолют ном давлении 0,1 атм. [c.114] Наиболее высокие выхода хлорной кислоты по току получены при концентрации соляной кислоты 0,8—2 н. При снижении концентрации соляной кислоты выход H IO4 по току уменьшается за счет повышения выхода кислорода по току. При повышении концентрации НС1 более 2 н. возрастает расход тока на выделение хлора и выход хлорной кислоты по току резко снижается. Значение оптимальной концентрации соляной кислоты в электролите повышается с уменьшением температуры электролиза и зависит также от концентрации хлорной кислоты в электролите. [c.428] Процесс анодного окисления соляной кислоты до хлорной сильно зависит от температуры. На рис. 8-3, б показана зависимость выхода продуктов электролиза по току от температуры раствора [63] при содержании в электролите 4 н. H IO4 и 1 н. НС1 и потенциале анода 2,8—3,0 В. С понижением температуры выход хлорной кислоты по току возрастает, а хлора и кислорода соответственно снижается. [c.428] Хлорная кислота может быть получена также анодным окислением хлора, растворенного в электролите. Электролитом служит 4—6 н, НСЮ4. Окисление хлора до хлорной кислоты проходит при высоком потенциале (2,8—3,0 В) на аноде из платины или платинированном титане. Суммарная реакция процесса [c.157] Цитратный фоновый электролит готовили растворением I моля лимонной кислоты и 0,1 моля сульфата алюминия в воде, доводя рК до 4,5 при помощи раствора КОН и разбавляя до объема 1 л. Окпслительно-восстано вптельный потенциал пары Ри(1У)/Ри(III) в этой среде равен —0,19 в относительно нас. к. э. Для работы с платиновой ячейкой прмгодны растворы азотной, соляной, серной и хлорной кислот. Были исследованы растворы 1 N НМОз и 1 N НС1, в которых потенциалы Ей равны примерно +0,67 и +0,71 в (отиоси-гельно нас. к. э.). В растворы НМОз вводили до 0,01 М сульфаминовой кислоты для уничтожения мешающего влияния нитрит-ионов. [c.222] Предложено использование платинотитановых аподов с платиновой фольгой, приваренной к титану контактной сваркой [139], для ряда процессов, в частности для электролиза соляной кислоты с целью получения хлора. Для повышения коррозионной стойкости платины в условиях электролиза в электролит вводят от 50 до 150 г/л хлорной кислоты [138]. При этом повышается также электропроводность электролита. [c.168] Уменьшение степени извлечения платины за счет ее катодного осаждения и увеличения равновесной концентрации Pt в вытекающем из электролизера растворе хлорной кислоты связано с изменением физико-химических свойств графитового катода при осаждении на нем платины. Лабораторными исследованиями показано [142], что равновесная концентрация Pt в электролите изменяется симба- но с поверхностью осажденной платины на графите. Оба эти показателя быстро возрастают при увеличении количества осажденной платины от 2 до 5 мг/см2 поверхности графитового анода и при дальнейшем росте практически не изменяются. Равновесная концентрация платины в электролите несколько возрастает с увеличением концентрации HGIO4 (от 300 до 600 г/л) и HG1 (от О до 30 г/л). [c.169] Увеличение (в определенных пределах) концентрации НС1 в электролите в процессе электролиза для получения хлорной кислоты при пиуких температурах iie сопровождается снижением выхода хлорной кислоты по току [143] и ыонсет применяться для уменьшения расхода платины на производство. [c.170] В работе [189] рассматривалось влияние природы органического растворителя и аниона на электроосаждение кадмия из водно-органических растворов хлорной кислоты. В 707о-ном водном растворе H IO4 растворялись фториды, бромиды, хлориды, иодиды, ацетаты и перхлораты кадмия и вводилась органическая компонента — ацетонитрил, диметилформамид, диметилсульфоксид, пиридин и различные ке-тоны. Авторы считают, что существует связь между параметрами осаждения кадмия (потенциал электрода, плотность тока, поляризуемость), адсорбционной активностью молекул растворителя на границе электрод—электролит и донорным числом растворителя. Формирование качественных слоев определяется конкурирующей адсорбцией воды, анионов и молекул органического растворителя. [c.57] Жолли " вычислил энтропию ионизации уксусной кислоты путем измерения теплоты нейтрализации ацетата натрия хлорной кислотой в уксуснокислом растворе. Это определение основано на предположении, что хлорная кислота полностью ионизирована в безводной уксусной кислоте. Основанием для такого утверждения послужило изучение диссоциации НСЮ4 Кольтгофом и Уилмэном , использовавших для этого кондуктометрические измерения. Авторы установили, что в растворе уксусной кислоты хлорная кислота ведет себя как сильный электролит частично [c.31] Мот и Перримен рекомендуют употреблять электролит, содержащий 2 части хлорной кислоты и 7 частей уксусного ангидрида, для полировки разнообразных сплавов алюминия, а Плате с сотр. применяли смесь 345 мл хлорной кислоты с 655 мл уксусного ангидрида-. Следует, однако, напомнить о возможности взрыва при употреблении смеси хлорной кислоты с уксусным ангидри-дом в случае неточного соблюдения мер предосторожности (см. главу XI). [c.157] Самое последнее определение величины F производилось в 1960 г. Крейгом, Гоффманом, Лоу и Хамером, которые пользовались при этом кулонометром типа показанного на рис. 4.2. Он состоит из трех пирексовых стаканов, соединенных сифонными трубками. В стаканы налит электролит, содержащий 20% хлорной кислоты и 0,5% хлорнокислого серебра, растворенных в воде. При электролизе на платиновом катоде осаждается серебро, а [c.219] Хлорную кислоту можно получать также анодным окислением хлора, )астворенного в электролите — в 4—6 н. растворе хлорной кислоты [19—24]. Три электролизе таких растворов на платиновых анодах и серебряных катодах электролизеры, рассчитанные на нагрузку 3,5 кА при плотности тока 2 кА/м и температуре О °С, работали при напряжении 4 В [25]. Процесс описывается суммарным выражением [c.85] chem21.info www.wewees.ruЭлектролит: основа свинцово-кислотных автомобильных аккумуляторов. В электролите какая кислота
какая кислота в электролите Видео



















Электролит: основа свинцово-кислотных автомобильных аккумуляторов
Что такое электролит?
Зачем в аккумуляторе электролит?
Типы и характеристики электролитов
Температура электролита,°C
Поправка к показаниям ареометра,г/куб. см
-55 … -41 -0,05 -40 … -26 -0,04 -25 … -11 -0,03 -10 … +4 -0,02 +5 … +19 -0,01 +20 … +30 0 +31 … +45 +0,01 +46 … +60 +0,02 Использование аккумуляторного электролита
Какая кислота залита в аккумуляторе автомобиля? - Моя газета



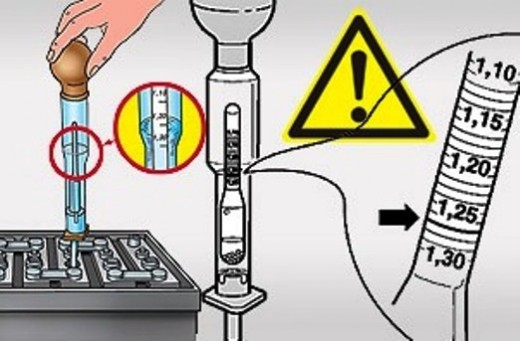
Плотность аккумулятора. Какая в электролите считается нормальной? Обязательно знать


Что такое электролит?

Какая плотность считается нормальной?

Почему плотность меняется при разрядах и зарядах?


А что если сильно повысить плотность?

Чем еще опасна низкая концентрация?
что залито в аккумулятор, состав кислотного электролита, из чего он состоит
Серная кислота в аккумуляторе


Состав кислотного электролита

Поднятие плотности в АКБ


Полезное видео
Какой электролит заливать?

Заключение
Хлорная кислота как электролит - Справочник химика 21
Технология производства хлорной кислоты состоит из следующих стадий приготовления электролита, электролиза, вакуумной дистилляции и получения безводной кислоты. Способ получения хлорной кислоты анодным окислением хлора позволяет получать очень чистую кислоту, так как с хлором в электролит не вводится никаких примесей. Для этого процесса приготовление электролита осуществляют путем насыщения хлором части хлорной кислоты, полученной после электролиза предварительно хлорная кислота охлаждается до —5° С. Раствор, насыщенный хлором, поступает на электролиз в анодное пространство электролизера, где происходит окисление хлора до хлорной кислоты, вследствие чего увеличивается ее концентрация. На электролиз, который осуществляют при 0°С, поступает электролит, содержащий 3 г/л растворенного хлора в 40%-ной кислоте. [c.157]
Такой метод предусматривает получение хлорной кислоты электрохимическим окислением НС1 или хлора в электролите из хлорной кислоты. Получаемая кислота может быть загрязнена ионами хлора и при использовании для производства очень чистого перхлората аммония должна быть очищена электролитически или отгонкой примесей в виде H I. При очистке хлорной кислоты электролитически [c.448]Электролит

Электролит
В качестве электролита для аккумуляторных батарей применяют раствор серной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности.
Плотность электролита зависит от концентрации раствора серной кислоты -- чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора -- чем выше температура, тем ниже плотность.
Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности
аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полного заряда.
Для уравнивания плотности электролита, т.е. доведения ее до плотности, равной плотности в начале эксплуатации, следует измерить фактическую плотность и температуру. Уравнивание можно проводить только в полностью заряженном аккумуляторе, когда электролит имеет плотность, не искаженную недозаряженностью последнего.
Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной кислоты с образованием воды. В заряженных аккумуляторах
концентрация кислоты равна 30...40%.
Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Многие вещества, например, незначительное количество солей железа попадая в электролит ускоряют выделение водорода и увеличивают саморазряд аккумулятора. Поэтому при приготовлении
электролита следует использовать только дистиллированную воду и использовать неметаллическую посуду. 


 Добавить сайт в избранное
Добавить сайт в избранное














.jpg)

