|
|
|
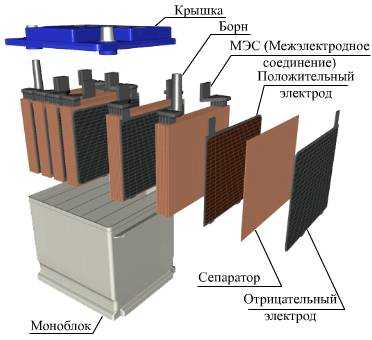
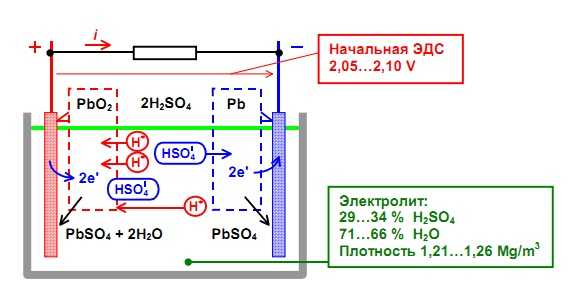
В автомобилях обычно применяют свинцово-кислотные аккумуляторы. Рассмотрим их устройство. Все элементы располагаются в корпусе, который изготавливают из полипропилена. Корпус состоит из емкости, разделенной на шесть ячеек, и крышки, оснащенной дренажной системой для стравливания давления и отвода газа. На крышку выводится два полюса (клеммы) – положительный и отрицательный. Содержимое каждой ячейки представляет собой пакет из 16 свинцовых пластин, полярность которых чередуется. Восемь положительных пластин, объединенных бареткой, являются плюсовым электродом (катодом), восемь отрицательных – минусовым (анодом). Каждый электрод выводится к соответствующей клемме аккумулятора. Пакеты пластин в ячейках погружены в электролит – раствор серной кислоты и воды плотностью 1,28 г/см3. Между пластинами электродов, для предотвращения замыкания, вставлены сепараторы – пористые пластины, которые не препятствуют циркуляции электролита и не взаимодействуют с ним. Отдельная пластина электрода – это решетка из металлического свинца, в которую впрессован (намазан) реагент. Активная масса катода – диоксид свинца (PbO2), анода – губчатый свинец. При разряде аккумулятора (подключении нагрузки) губчатый свинец анода выделяет положительные двухвалентные ионы свинца в электролит. Избыточные электроны перемещаются по внешней замкнутой электрической цепи к катоду, где происходит восстановление четырехвалентных ионов свинца до двухвалентных. При их соединении с отрицательными ионами серного остатка электролита, образуется сульфат свинца на обоих электродах. Ионы кислорода от диоксида свинца катода и ионы водорода из электролита соединяются, образуя молекулы воды. Поэтому плотность электролита понижается. При заряде происходят обратные реакции. Под воздействием внешнего напряжения ионы двухвалентного свинца положительного электрода отдают по два электрона и окисляются в четырехвалентные. Эти электроны движутся к аноду и нейтрализуют ионы двухвалентного свинца, восстанавливая губчатый свинец. На катоде, путем промежуточных реакций, снова образуется двуокись свинца. Химические реакции в одной ячейке вырабатывают напряжение 2 В, поэтому на клеммах аккумулятора из 6 ячеек и получается 12 В. Из видео Вы сможете более подробно узнать, как работает аккумулятор: Читайте также, как правильно выбрать аккумулятор по емкости, особенности литий-ионных и никиль-кадмиевых аккмуляторов pue8.ru Работа электромобиля основана на электрическом токе. Внешне такие машины трудно отличить от авто с бензиновым двигателем. Единственная заметна разница в шуме при движении: электромобиль передвигается практически бесшумно. По типу организации работы эти виды машин существенно отличаются. В электроавтомобиле установлен двигатель, функционирующий от электрического тока и получающий энергию от аккумуляторов. Основные виды аккумуляторных батарей В основе работы электромотора лежит принцип индукции электромагнитной природы. Данный тип двигателя преобразовывает энергию электриеской природы в механическую. Этот двигатель имеет высокий показатель КПД (коэффициента полезного действия). Он может достигать 95%. Главный источник энергии электромотора – батареи аккумуляторной природы. Такие источники питания довольно дорогостоящие, что является главной причиной недостаточной распространенности электромобилей. Наиболее популярный и доступный вид аккумуляторов – источники питания со свинцово-кислотным наполнителем. Также эти батареи почти полностью перерабатываются, что уменьшает их отрицательное влияние на экологию. Следующий вид аккумуляторов – никель-металлогибридные. Они дороже, чем представленные ранее, но имеют более высокие показатели производительности. Литий-ионные источники питания – идеальные для автомобилей с электрическим двигателем. Они наименее распространены среди автовладельцев из-за своей высокой стоимости. Зачастую в электромобилях, кроме батарей, питающих двигатель, устанавливают дополнительный источник питания, обеспечивающий функционирование фар, магнитолы, стеклоочистителей и других аксессуаров вашего транспортного средства. Источник питания с литий-ионным наполнителем очень распространен сегодня в бытовой электронике и широко применяется в автомобилях с электрическими двигателями и энергетических системах (мобильные телефоны, ноутбуки, цифровые фотоаппараты и т.д.). Литий-ионный аккумулятор является наилучшим вариантом для питания электромобилей. Его составляющие: Корпус оснащен предохранительным клапаном, главная функция которого – сбрасывать внутреннее давление при авариях и нарушении условий использования двигателя. Литий-ионные аккумуляторы различаются в зависимости от характера материала на катоде. «Транспортером» заряда в этом источнике питания есть ион лития с положительным зарядом, который может вклиниваться в кристаллическую структуру таких материалов, как графит и различные соли, с созданием связи химической природы. Сегодня при обширном производстве описанного вида аккумулятора используют такие три вида сырья катодной природы: Аккумуляторы с литий-ионным наполнителем имеют существенные преимущества в сравении с их сородичами. Это низкие показатели Компания «Тесла Моторс» создает популярные «экологичные» электромобили, которым присущи специфические свойства, делающие машины популярнее с каждым днем. Одной из составляющих успеха продуктов компании являются батареи литий-ионной природы, размещенные в электроавто. Для начала стоит отметить, что вся сборка аккумулятора характеризуется повышенной плотностью и точностью сочетания составляющих. Батарея имеет 16 составляющих – блоков параллельного соединения, огражденных пластинами из металла и пластиковой защитой батареи от воды. Каждый блок аккумулятора имеет разделенные на шесть групп 74 составляющих компонента, похожих на привычные пальчиковые батарейки. Схема их размещения и принцип работы держатся в строжайшем секрете! Электрод с положительным зарядом – это графит, а с отрицательным – никель, кобальт и оксидный алюминий. Наимощнейший из подобных аккумуляторов сложен из 7104 похожих батарей. Имеет вес 540 кг, длину – 2м 10см, ширину – 1м 50см и 15 см толщину. Энергия, вырабатываемая одним из 16 блоком, равна продуцируемой сотней аккумуляторов портативных компьютеров. При производстве аккумуляторов Тесла используют детали, созданные в Мексике, Китайской народной республике и Индии. Конечная работа производится в США. Гарантия, предоставляемая компанией, значительна: до 8 лет. В статье описан состав наиболее распространенных источников питания для двигателей электромобилей. Надеемся, информация будет полезной для Вас! ekowheel.com Корпус большинства аккумуляторов состоит из ударопрочного полипропилена. Этот материал выбран не случайно. Он легкий, а так же не вступает в химическую реакцию с агрессивным электролитом АКБ. Полипропилен довольно стоек к перепадам температур, которые порой достигают диапазона от -30̊ С до +60 ̊С под капотом Вашего автомобиля. Давайте разберем из каких элементов состоит сам корпус аккумуляторной батареи. Итак, большинство АКБ имеют такие элементы: - ручка, которая используется для удобства переноса батареи человеком, что бы он не уронил случайно источник питания, который довольно прилично весит. - пробки, 6 штук. Пробки позволяют проникнуть внутрь каждой секции (банки) аккумулятора. Когда мы открутим пробки, то сможем проверить уровень электролита, цвет его, плотность и определить в каком состоянии находится батарея. - индикатор заряда или ещё часто называют «глазок». Он устанавливается на какую-то конкретную секцию батареи. Может быть на крайней банке АКБ или посередине, зависит от производителя и не имеет особого значения. Этот индикатор показывает уровень заряда батареи. Хочется обратить Ваше внимание, что «глазок» стоит только на одной банке, поэтому если соседняя секция замкнула, то Ваш индикатор может показывать что АКБ полностью исправен, а на самом деле это будет не так. Поэтому, желательно проводить диагностику всех секций (банок) аккумулятора, нежели ориентироваться только на «глазок». Это даст более точную картину состояния аккумуляторной батареи. - Также, на верхней поверхности любого аккумулятора есть клеммы. Через которые он и подключается к электросети автомобиля. Клеммы, в основном, стандартного размера, но плюсовой вывод всегда больше минусового по диаметру. Это сделано для того, что бы невнимательный водитель не перепутал полярность при установке АКБ на авто. Давайте отметим, что много производителей аккумуляторных батарей делают необслуживаемые корпуса. К ним относятся такие «гиганты» как Varta, Bosch, Rocket, Mutlu и многие другие. В чём отличия обслуживаемых от необслуживаемых АКБ? Если есть пробки, которые откручиваются, то батарея подлежит обслуживанию. То есть, производитель рекомендует доливать дистилированую воду, когда она выкипит в процессе эксплуатации. Завод-производитель необслуживаемых АКБ, вроде как, предусмотрел этот процесс. Вместо пробок они сделали систему клапанов. Эти клапаны не дают испарениям выйти из корпуса батареи, а они стекают обратно в банки. Обслуживания как такового не требуется, а только приодическая зарядка. Далее, если мы снимем верхнюю крышку АКБ, то мы увидим шесть секций. В каждой из этих банок находятся как положительные, так и отрицательные пластины. Каждая из этих пластин упакована в сепаратор. Сепаратор – это такой конверт, который предотвращает замыкание между пластинами. В зависимости от того, сколько пластин положительных и отрицательных сложено в каждую секцию и соответственно мы получаем большую либо меньшую рабочую поверхность. И из этого складывается ёмкость самого аккумулятора. Соответственно, чем больше пластин тем больше ёмкость. Поэтому корпуса разные по размеру, в зависимости от ёмкости. Каждая заряженая секция (банка) аккумулятора имеет напряжение 2,13 В. Так как автомобильный АКБ 12-ти вольтовый, мы имеем 6 таких секций и полностью заряженный источник питания имеет напряжения около12,78 В. Электролит - химический элемент, который служит проводником электрического тока. Он состоит из двух компонентов это серная кислота и вода. Оптимальное соотношение электролита, которое необходимо для нормального функционирования аккумуляторной батареи 1,27 грамма кислоты на см3 воды. Электролит различают трех видов: 1. Жидкий электролит; 2. В виде геля; 3. Абсорберы или связанный электролит. Давайте разберем более подробно каждый из видов. Это обычный раствор кислоты и воды, который находится в жидком состоянии в АКБ. Такие батареи у большинства автовладельцев. Как Вы уже догадались у самого слова «гелевый», означает что он находится в загущенном состоянии, в виде геля. Какие преимущества этих аккумуляторов? Преимущества их в том что, как правило, они имеют герметичный корпус, то есть, полностью запаянный, доступа к банкам или к секциям аккумулятора у них нет. И за счет того, что электролит находится в густом состоянии, он не вытекает. То есть, при кипении аккумулятора, допустим генератор подаёт большое напряжения, он перезаряжается. Начинают накапливаться газы и происходить перезаряд, то обычный электролит начинает обильно кипеть. В результате кипения испаряется вода. И из-за перезаряда (неисправного генератора) аккумулятор выходит из строя. В гелевых батареях это происходит не таким образом. Аккумулятор имеет более густой электролит, не так подвержен кипению, корпус герметичный и все процессы циркулируют внутри самого корпуса. И нет выкипания воды из геля. Даже если в корпусе образовалось какое-то отверстие, батарея не теряет свою работоспособность. Он может потерять только ёмкость, если мы механически повредили секции внутри. Плюс еще в том, что в загущеном состоянии проводимость тока у него улучшается. В таком электролите более быстро происходят химические реакции. АКБ быстрее отдает ток, который необходим и так же быстрее его восстанавливает. Гелевые аккумуляторы, как правило, заряжаются во много раз чем обычный кислотный. Также, к достоинствам нужно отнести, что они не боятся глубокого разряда. У них не происходит, в таких случаях сульфатация пластин. И имеют высокий пусковой ток. Так называемые абсорберы или связанный электролит. В чем их отличия? Сепаратор или «конверт» в который укладывается пластина, состоит из микроволокна, похожего на стекловату. Если мы на стекловату добавим какую-то жидкость, то капельки будут находится на маленьких ворсинках из которых состоит структура самого сепаратора. Получается что электролит не в жидком состоянии бультыхается как вода, а держится на ворсинках материала. Он вроде как жидкий, но в то же время не вытекает. Преимущества схожи с гелевыми АКБ. Они тоже не так боятся повреждения корпуса батареи, меньше подвержены сульфатации пластин. Выкипания воды практически нет. blog-avto.com Электрохимическая батарея состоит из катода, анода и электролита. При зарядке аккумуляторной батареи происходит накопление электронов на аноде, которое создает потенциал напряжения между анодом и катодом. При обычной работе в качестве источника питания ток протекает от катода к аноду через нагрузку. При зарядке аккумулятора ток течет в противоположном направлении. Электроды батареи связаны между собой двумя различными путями, первый это электрический контур, через который электроны текут питать нагрузку, а второй - через электролит, где ионы движутся между электродами через диэлектрический разделитель (сепаратор). Рассмотрим подробнее эти три компонента батареи. Электрод, который высвобождает электроны в ходе окислительно-восстановительной реакции, называется анод. Электрический потенциал анода гальванического элемента отрицателен по отношению к катоду. Химическая реакция в аккумуляторной батарее является обратимым процессом, и, следовательно, полярность электродов меняется в зависимости от режима работы (заряд/разряд), но обозначение клемм всегда постоянно. В таблицах 1a, b, c и d описывается состав и процессы в литиевых, свинцовых, никелевых и щелочных батареях. Таблица 1a: Состав и процессы в литий-ионном аккумуляторе. Таблица 1b: Состав и процессы в свинцово-кислотном аккумуляторе. Таблица 1c: Состав никель-металл-гидридного и никель-кадмиевого аккумуляторах. Таблица 1d: Состав щелочной (алкалиновой) батарейки. При затопленной негерметичной системе конструкции аккумулятора, жидкий электролит свободно течет между двумя электродами. В герметичных же конструкциях электролит обычно выступает в роли пропитки для сепаратора, чтобы обеспечивать движение ионов от катода к аноду и в обратном направлении при зарядке. Ионы – это атомы, которые присоединили или потеряли электроны. Потеряв благодаря этому электронейтральность, они приобретают способность двигаться между электродами через сепаратор. Сам же сепаратор является диэлектрическим, то есть не способным к электропроводности. Смотрите также: Какую функцию выполняет в электрической батарее сепаратор? и Для чего в электрической батарее нужен электролит? best-energy.com.ua Устройства, способные накапливать электроэнергию и служить ее временным источником, уже давно вошли в наш обиход. Применение аккумуляторов зависит от основных параметров прибора, таких как емкость, долговечность и размер. Разумеется, каждый производитель вкладывает в свои устройства фирменные разработки, поэтому аккумуляторы имеют не только внешние, но и технические различия. Однак Свинцово-кислотные аккумуляторы состоят из пары свинцовых пластин-электродов, опущенных в электролит из серной кислоты и воды. Пластины никелево-кадмиевых элементов скатаны в трубку и разделены изоляционным материалом с электролитной пропиткой. Никелево-металлогидридные батареи отличаются от никелево-кадмиевых составом электролитного раствора и материалом электродов. Компоненты литиево-ионного электронакопителя помещены в раствор из соли лития. В последние годы было изобретено еще два вида аккумуляторных батарей. В литиево-полимерном элементе вместо жидкого электролита используется полимерная пленка. Как правило, подобные батареи отличаются высокой плотностью заряда и очень небольшими размерами. Благодаря этим качествам подобные батареи используются в малогабаритных устройствах, например, в телефонах. Вторым новым видом стали аккумуляторы гелевые. Роль электролита в них играет силикагель. Эта желеобразная, чуть подсушенная прослойка между электролитами пронизана сот Применение аккумуляторов в какой-либо области зависит не только от их видов, но и от емкости устройств. И у обычной батарейки, и у автоаккумулятора этот основной параметр рассчитывается в одинаковых единицах, ампер-часах. Так, емкость 800 мА*ч означает, что данная батарея за час отдает 800 мА электроэнергии. Еще один немаловажный параметр аккумуляторной батареи – число циклов перезарядки. Чем больше это число, тем дольше прослужит устройство. Кроме внутренних компонентов, все электронакопители различаются по области применения. К бытовым элементам относятся батарейки различных типов и ультратонкие аккумуляторные батареи ноутбуков и планшетов. Промышленные аккумуляторы, как правило, являются вторичными источниками электроэнергии и Производство аккумуляторов постоянно развивается. Изобретаются новые виды миниатюрных, емких батарей, не наносящих вреда окружающей среде. Применение аккумуляторов с новыми технологиями делает современную жизнь комфортнее и мобильнее. fb.ru Аккумулятор – многоразовый источник тока химического действия, в основу которого положен принцип обратимости химических процессов (окислительно-восстановительная реакция), что обеспечивает многократное его использование. Аккумулятор используется для накопления энергии и дальнейшего его использования как автономный источник энергии в различных электротехнических устройствах. Аккумуляторная батарея – это несколько аккумуляторов, соединённых в одну электрическую цепь. Устройство аккумулятора Принцип действия аккумулятора, как уже было сказано ранее, исходит из обратимости химических процессов, то есть при полностью разряженном аккумуляторе, мы можем восстановить его работоспособность путём заряда, пропуская электрический ток в направлении, обратном направлению при разряде. Ёмкость аккумулятора – это величина заряда, который отдается полностью заряженным аккумулятором при разряде до момента наступления наименьшего допустимого напряжения, другими словами это максимальный полезный заряд аккумулятора. Ёмкость аккумулятора на практике чаще всего измеряют в так называемой единице «ампер час», в системе СИ ёмкость измеряют в кулонах, и соответственно 1 ампер-час = 3600 Кл соответственно. Иногда еще используется такое понятие как – энергия, которую аккумулятор отдает с полностью заряженного аккумулятора при разряде до наименьшего допустимого напряжения, в системе СИ она измеряется в джоулях, на практике «ватт час», 1 Вт*ч = 3600 Дж. Характеристики аккумуляторных батарей Характеристики аккумулятора в первую очередь зависят от металла из которого сделаны электроды и состава электролета. Наиболее распространёнными сейчас являются: 1. Свинцово-кислотный (Lead Acid) – самый распространённый тип аккумуляторной батареи, который используется в автомобилях, или же как источники бесперебойного питания в аварийных случаях. 2. Никель-кадмиевые (NiCd) – наибольшее распространение получили как замена стандартного гальванического элемента, так же применяются в электрокарах, трамваях и троллейбусах для осуществления питания цепей управления. 3. Никель-металлогидридные (NiMH) – так же используются как замена стандартного гальванического элемента, в электромобилях, радиоаппаратуре, осветительной технике. 4. Литий-ионные (Li-ion) – нашел применение в современных бытовых и строительных приборах, а так же в мобильных устройствах. 5. Литий-полимерные (Li-pol) – используется в мобильных устройствах и цифровой технике 6. Никель-цинковые (NiZn) – используется как стандартный гальванический элемент Рисунок 1 - Разновидности аккумуляторных батарей С момента полной зарядки и в процессе использования аккумулятора, его напряжение и ток падают, что связано с протеканием окислительной реакции в нём. Зарядка аккумуляторной батареи осуществляется от любого источника постоянного тока. Для каждого отдельно взятого аккумулятора напряжение и ток зарядки разные, их величины мы рассмотрим в последующих статьях непосредственно для каждого из них. Так же, при зарядке батарей необходимо учесть различные ограничения для каждого из типов, к примеру, NiCd- и NiMH аккумуляторы имеют так называемый эффект памяти ( зарядка аккумулятора который не полностью разрядился) , поэтому такие аккумуляторы нужно разряжать полностью, и только потом ставить на зарядку, для продолжения их срока службы и последующей эксплуатации. NiMH аккумуляторы – очень чувствительны к перезаряду, а Li-ion и Li-pol наоборот – к переразряду. Так же данным типам аккумуляторов можно отнести заметный саморазряд, что говорит о том, что будучи заряженными и не подключенными к нагрузке, они будут терять свой заряд, и если вы их храните не используя, то вам необходимо постоянно проверять их уровень заряда, и при необходимости заряжать. Или же использовать метод капельной подзарядки – это подзарядка аккумулятора малым током, для того что бы скомпенсировать его саморозряд. h4e.ru Свинцово-кислотные аккумуляторы находят свое применение в обслуживании современной бытовой, промышленной техники, устанавливаются в автомобили, являются способом основного или резервного питания различной электроники. В этом обзоре мы попробуем ответить ключевые вопросы: какие типы свинцово-кислотных аккумуляторов есть на сегодняшний день? какие ключевые особенности каждого вида? для чего и где применяются? В зависимости от целей и особенностей применения аккумуляторов в быту или промышленности различаются три режима работы таких устройств: буферный режим, циклический и смешанный. Все они основаны на особенностях разрядных и зарядных процессов, происходящих внутри батареи. В таком режиме аккумулятор совершает своеобразный цикл – полностью разряжается, а затем полностью заряжается. Специалисты считают такое использование аккумулятора наиболее жестким, так как каждая модель ограничена определенным запасом циклов стопроцентного разряда. Например, в современных автомобильных аккумуляторах типа AGM (о самом типе мы поговорим позже) средний циклический ресурс составляет около трехсот полных разрядов и зарядов батарей. Существуют более дорогостоящие и более «мощные» в этом плане модели, которые рассчитаны на шестьсот и более циклов. Однако в автомобилях полный разряд батареи встречается редко. Экстремальные условия полного разряда батареи можно встретить в различных бытовых приборах, например, в поломоечных машинах. В таких агрегатах аккумуляторы стопроцентно разряжаются и заряжаются за день около трех раз. В результате эксплуатационный срок в таком «серьезном» режиме составляет всего лишь около шести месяцев. Данный режим является наиболее распространенным в современном применении. Для батарей буферный режим работы считается самым приемлемым, так как в результате работы батарея разряжается не полностью. Аккумуляторы в таком режим находятся всегда подключенными к источнику питания, поэтому глубокие разряды происходят крайне редко. Соответственно, износоустойчивость батарей в таком режиме работы существенно повышается. Наиболее знакомый всем вариант применения аккумуляторов в буферной работе – это использование в качестве источника бесперебойного питания. К примеру, аккумуляторы такого типа устанавливаются на стационарные компьютеры. В смешанной работе аккумулятора происходит комбинация двух режимов – буферного и циклического. Аккумулятор основное свое время работы «проводит» в режиме буферного питания, во время которого иногда случаются глубокие разряды. Уже упоминавшееся «автомобильное» применение аккумулятора – распространенный вариант смешанного режима работы. Устройство свинцово-кислотных аккумуляторов несложное, но требует дополнительного разъяснения. Основными элементами таких моделей являются электродные пластины, которые изготавливаются из свинца, и электролит – раствор серной кислоты (h3SO4). Именно такой химический состав аккумуляторов начинает взаимодействовать между собой при процессах разряда и заряда батарей. Электроды имеют решетчатую структуру и покрыты активными массами – специальными порошками, которые повышают разделительную поверхность электролитного вещества. Таким образом увеличивается емкостный запас аккумулятора. Положительные пластины (аноды) запрессовываются внутрь решетчатых пор активной массой диоксида свинца, имеющего химическую формулу PbO2. На отрицательных электродных пластинах (катодах) применяется обычный свинец (Pb), который еще называют «губчатым». Между электродными пластинами помещаются еще дополнительные разделительные решетки – сепараторы, которые препятствуют замыканию электродов между собой во время разряда или заряда. В современных аккумуляторных моделях для изготовления электродных решеток используются дополнительные металлы. В чистом виде свинец встретить практически невозможно, так как по своим физическим свойствам он не отличается прочностью. Пластины дополнительно «оснащаются» каким-нибудь более твердым веществом, преимущественно сурьмой, в редких случаях кальцием (иногда кальций добавляется в состав или в анодные решетки, или только в катодные). Электролит – это раствор серной кислоты, в которую погружены решетки анода и катода вместе с сепараторными пластинами. Для увеличения эксплуатационного срока в современных аккумуляторах используют только дистиллированную воду, чтобы приготовить раствор кислоты. В обычной воде всегда содержится агрессивная среда – различные соли (кальций, магний), что негативно сказывается на работе батареи. WET-аккумуляторы – классические батареи, устройство которых мы подробно описали выше. Такие модели называются аккумуляторами со «свободной» кислотой – с жидким электролитным веществом (в данном случае – это раствор серной кислоты h3SO4). В связи с конструктивными особенностями отдельных моделей, в которых внутренний состав и строение электродных решеток может отличаться, батареи со свободной кислотой разделяются на три группы. Эта классификация учитывает особенности реальной эксплуатации батарей. Некоторые модельные варианты необслуживаемых батарей оснащены так называемым «магическим глазом» - специальным индикатором. Он позволяет приблизительно понять, какое количество электролита осталось внутри: зеленый цвет – модель полностью заряжена, красный цвет – практически полный разряд, белый цвет – осталось мало электролита. При белом цвете индикатора аккумулятор обычно меняют на новую модель, так как в таких моделях не предусмотрены специальные отверстия для воды. Модели данного типа относятся к аккумуляторам необслуживаемым, со свободной кислотой. Это новое поколение аккумуляторных батарей, разработанных специально для небольших автомобилей с инновационной системой Start&Stop. Если вкратце, то такая система позволяет уменьшить расход топлива автомобиля и выброс газов. Двигатель таких машин автоматически отключается при остановке автомобиля и запускается при нажатии сцепления или отпускания тормозной педали. Такие особенности системы не могли не повлиять и на производство новой разновидности батарей. В целом, аккумуляторы типа AFB конструктивно похожи на строение классических батарей со свободной кислотой. Однако есть свои нюансы: Основные преимущества подобных батарей – это увеличенный эксплуатационный срок в циклическом режиме работы, более мощные пусковые возможности. Аккумуляторные батареи VRLA – это свинцово-кислотные модели, в которых используется специальная система клапанной регулировки. Конструктивное строение аккумуляторов позволяют использовать их в помещениях без вентиляционного оборудования: данные модели практически не выделяют опасных газов. Батареи относятся к типу необслуживаемых, поэтому необходимости доливать воду внутрь аккумулятора нет необходимости. Благодаря такой констуркции и особенностям модели получили название «герметизированных необслуживаемых» моделей. Существует три разновидности аккумуляторных батарей VRLA: аккумуляторы технологии AGM, гелевые батареи GEL и аккумуляторы Dryfit. Данный тип аккумуляторов помимо стандартных элементов (электродных пластин и кислотного электролита) оснащен дополнительным абсорбентом. В качестве абсорбирующего вещества в современных моделях используется стекловолокно. Аккумуляторы AGM – единственные модели, которые не требуют никакого эксплуатационного обслуживания. Абсорбирующее вещество (стекловолокнистый материал) служит для возможности так называемой рекомбинации газов. В классических моделях батарей при заряде аккумулятора происходит процесс распада молекул воды (h3O) на два газа – кислород (O) и водород (H). Выделяемые газы в обычных моделях со свободной кислотой выходят через специальные вентиляционные отверстия. В батареях типа AGM за удержание кислоты отвечает специально внедренная пластина пористой структуры из стекловолокна. Процесс происходит следующим образом: в результате распада водной молекулы выделенный кислород от положительного электрода перемещается на отрицательную пластину. На катоде кислород удерживается до тех пор, пока не происходит новый процесс рекомбинации – кислород соединяется с водородом, заново образуя воду. Однако избыток газа в результате таких химических процессов может все-таки возникнуть. Незначительное количество выделяется через специальный клапан, расположенный на корпусе батареи. В целом, аккумуляторы данного типа являются более безопасными и комфортными при использовании: практически не выделяют газов, не требуют никакого обслуживания. В современных автомобилях именно аккумуляторы AGM используются чаще всего, в том числе благодаря лучшим пусковым возможностям. Аккумуляторы GEL имеют похожую конструкцию с батареями свободной кислоты, однако в роли электролита здесь выступает не жидкий раствор кислоты, а гель – точнее силикагель. Такой электролит позволяет увеличить емкость батареи, так как при внутренних химических процессах гель незначительно подсыхает, препятствуя испарению. Благодаря физическим и химическим свойствами гелевые аккумуляторы чаще всего используются в областях энергетики, а не в силовых отраслях (как автомобильная система). Гелевые батареи наиболее распространены в промышленных производствах, где необходима стойкость к разрядам и зарядам, комфортный и надежный буферный режим работы. Аккумуляторы долговечны, без какого-либо обслуживания. Еще одна разновидность аккумуляторов VRLA с желеобразным электролитным веществом – батареи типа Dryfit. По своей структуре данные аккумуляторные батареи относятся к типу моделей со свободной кислотой – свинцовые электродные пластины и серная кислота в роли электролита. Однако дополнительно в раствор серной кислоты разработчики добавляют специальный загуститель. В изготовлении свинцовых электродов не участвует сурьма, ее заменяют кальцием или олово. Электролит в желеобразной форме, как и гелевый электролит, участвует в процессе газовой рекомбинации. Одним словом, выделение газов из аккумулятора минимально. Модели данной модификации стойки к глубоким разрядам, очень быстро восстанавливают емкость, долговечны по сравнению с классическими батареями со свободной кислотой. kwatt.com.uaАккумулятор: устройство, назначение, принцип работы. Состав аккумулятора
устройство, разновидности, назначение, принцип работы
 Аккумулятор представляет собой устройство, которое накапливает энергию в химической форме при подключении к источнику постоянного тока, а затем отдает ее, преобразуя в электричество. Его используют многократно за счет способности к восстановлению и обратимости химических реакций. Разряжается – снова заряжают. Применяются аккумуляторы в качестве автономных и резервных источников питания для электротехнического оборудования и различных устройств.
Аккумулятор представляет собой устройство, которое накапливает энергию в химической форме при подключении к источнику постоянного тока, а затем отдает ее, преобразуя в электричество. Его используют многократно за счет способности к восстановлению и обратимости химических реакций. Разряжается – снова заряжают. Применяются аккумуляторы в качестве автономных и резервных источников питания для электротехнического оборудования и различных устройств.Устройство аккумулятора
Принцип действия аккумуляторов
 Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.
Принцип действия аккумулятора основан на образовании разности потенциалов между двумя электродами, погруженными электролит. При подключении нагрузки (электротехнических устройств) к клеммам аккумулятора в реакцию вступают электролит и активные элементы электродов. Происходит процесс перемещения электронов, который, по сути, и является электротоком.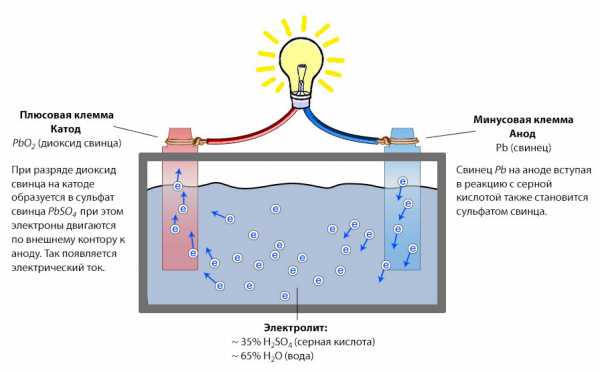
Строение аккумуляторов электромобилей внутри, основа движения двигателя



Особенности и строение аккумулятора с литий-ионным наполнителем


TeslaModel S: взгляд изнутри
Каково же строение источника питания Тесла?


Из чего состоит корпус аккумулятора. Что внутри банок?
Корпус необслуживаемой АКБ
Что же под верхней крышкой?

Электролит
Жидкий электролит
Гелевый электролит
Технология AGM
Также на эту тему:
Из каких элементов состоит аккумуляторная батарея
Категория: Поддержка по аккумуляторным батареям Опубликовано 01.03.2016 05:05 Автор: Abramova Olesya Анод и катод
Литий-ионная батарея
Катод
Анод
Электролит
Материальный состав элементов
Оксиды кобальта, никеля, марганца, железа и алюминия
На углеродной основе
Соли лития в органическом растворителе
Состав и процессы при заряженном состоянии
Оксид металла с интеркаляционной структурой
Миграция ионов лития к аноду
Состав и процессы при разряженном состоянии
Ионы лития возвращаются к положительному электроду
В основном, углеродная основа
Свинцово-кислотная батарея
Катод
Анод
Электролит
Материальный состав элементов
Диоксид свинца
Серый губчатый свинец
Соляная кислота
Состав и процессы при заряженном состоянии
Диоксид свинца PbO2, электроны присоединяются
Свинец Pb, электроны отсоединяются
Сильная серная кислота
Состав и процессы при разряженном состоянии
Свинец преобразуется в сульфид свинца, на аноде – с выделением электронов, а на катоде - с присоединением
Слабая серная кислота (разбавленная водой)
NiMH, NiCd
Катод
Анод
Электролит
Материальный состав элементов
Никель
NiMH: водородопоглощающий сплавNiCd: кадмий
Гидроксид калия
Щелочная (алкалиновая) батарейка
Катод
Анод
Электролит
Материальный состав элементов
Диоксид марганца
Цинк
Водный раствор щелочи
Электролит и сепаратор
Применение аккумуляторов и их разновидности
 о эти особенности не мешают разделить накопители на несколько основных видов.
о эти особенности не мешают разделить накопители на несколько основных видов. нями микроскопических трещин. Вещества, испаряемые электролитами, впитываются в гель и превращаются в жидкость. Таким образом, большая часть вредных испарений остается внутри аккумулятора.
нями микроскопических трещин. Вещества, испаряемые электролитами, впитываются в гель и превращаются в жидкость. Таким образом, большая часть вредных испарений остается внутри аккумулятора. используются как замена стационарной электросети. Обычно подобные аккумуляторы состоят из нескольких пар последовательно соединенных электролитов. К этому типу относятся как автомобильные батареи, так и мощные устройства, «выпрямляющие» электроток. Все промышленные энергонакопители распределяются по четырем категориям. Статерные батареи используются для запуска транспортных двигателей, стационарные поддерживают электропитание выпрямительных устройств, тяговые обеспечивают энергией электрокары, портативные «питают» измерительную аппаратуру. Применение аккумуляторов промышленного типа, как правило, осуществляется на заводах и других промышленных предприятиях. Мощные батареи обеспечивают электроэнергией станки, автопогрузчики и прочую крупную технику.
используются как замена стационарной электросети. Обычно подобные аккумуляторы состоят из нескольких пар последовательно соединенных электролитов. К этому типу относятся как автомобильные батареи, так и мощные устройства, «выпрямляющие» электроток. Все промышленные энергонакопители распределяются по четырем категориям. Статерные батареи используются для запуска транспортных двигателей, стационарные поддерживают электропитание выпрямительных устройств, тяговые обеспечивают энергией электрокары, портативные «питают» измерительную аппаратуру. Применение аккумуляторов промышленного типа, как правило, осуществляется на заводах и других промышленных предприятиях. Мощные батареи обеспечивают электроэнергией станки, автопогрузчики и прочую крупную технику.Аккумуляторные батареи. Виды аккумуляторов - Help for engineer
Аккумуляторные батареи. Виды аккумуляторов

Добавить комментарий
Свинцово-кислотные аккумуляторы: типы и ключевые особенности
Режимы работы аккумуляторов
Циклический режим
Буферный режим
Смешанный режим
Конструктивные особенности свинцово-кислотных аккумуляторов
Аккумуляторы типа WET
Типы аккумуляторных батарей со свободной кислотой
AFB-аккумуляторы
Разновидности аккумуляторов VRLA
Аккумуляторы AGM
Гелевые аккумуляторы
Батареи технологии Dryfit

 Добавить сайт в избранное
Добавить сайт в избранное












.jpg)

