|
|
|
1. Электролиты - это вещества, растворы или расплавы которых проводят электрический ток. 2. К электролитам относятся щелочи, растворимые соли и кислоты. 3. В водных растворах электролиты распадаются на ионы. 4. Неэлектролиты - вещества, растворы которых не проводят электрический ток. 5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др. 6. Слабые кислоты: h3S, h3CO3, HF, h3SO3, h3SiO3, органические кислоты Давайте порассуждаем вместе 1. К электролитам относится 1) метанол 2) железо 3) хлорид железа (II) 4) оксид железа (III) Ответ: электролитом является хлорид железа (II) - растворимая соль 2. К электролитам относится 1) фосфор 2) сера 3) глюкоза 4) уксусная кислота Ответ: электролитом является уксксная кислота - т.к. это растворимая кислота. 3. К слабым электролитам не относится 1) соляная кислота 2) сероводород 3) угольная кислота 4) уксусная кислота Ответ: соляная кислота не относится к слабым электролитам, это сильный электролит 4. К сильным электролитам не относится 1) бромоводород 2) хлороводород 3) сероводород 4) серная кислота Ответ: сероводород - это слабый электролит, не относится к сильным электролитам 5. Сильным электролитом является 1) угольная кислота 2) серная кислота 3) сахароза 4) метан Ответ: серная кислота - сильный электролит 6. Не является электролитом 1) поваренная соль 2) щелочь 3) азотная кислота 4) спирт Ответ: спирт не является электролитом 7. К электролитам относится 1) C2H5OH 2) C2h5 3) Ca(OH)2 4) CO Ответ: Ca(OH)2 - малорастворимое основание, значит относится к электролитам dx-dy.ru 1. Электролиты - это вещества, растворы или расплавы которых проводят электрический ток. 2. К электролитам относятся щелочи, растворимые соли и кислоты. 3. В водных растворах электролиты распадаются на ионы. 4. Неэлектролиты - вещества, растворы которых не проводят электрический ток. 5. К неэлектролитам относят простые вещества (металлы и неметаллы), оксиды, большинство органических веществ: углеводороды, спирты, альдегиды, углеводы, простые и сложные эфиры и др. 6. Слабые кислоты: h4S, h4CO3, HF, h4SO3, h4SiO3, органические кислоты Давайте порассуждаем вместе 1. К электролитам относится 1) метанол 2) железо 3) хлорид железа (II) 4) оксид железа (III) Ответ: электролитом является хлорид железа (II) - растворимая соль 2. К электролитам относится 1) фосфор 2) сера 3) глюкоза 4) уксусная кислота Ответ: электролитом является уксксная кислота - т.к. это растворимая кислота. 3. К слабым электролитам не относится 1) соляная кислота 2) сероводород 3) угольная кислота 4) уксусная кислота Ответ: соляная кислота не относится к слабым электролитам, это сильный электролит 4. К сильным электролитам не относится 1) бромоводород 2) хлороводород 3) сероводород 4) серная кислота Ответ: сероводород - это слабый электролит, не относится к сильным электролитам 5. Сильным электролитом является 1) угольная кислота 2) серная кислота 3) сахароза 4) метан Ответ: серная кислота - сильный электролит 6. Не является электролитом 1) поваренная соль 2) щелочь 3) азотная кислота 4) спирт Ответ: спирт не является электролитом 7. К электролитам относится 1) C2H5OH 2) C2h5 3) Ca(OH)2 4) CO Ответ: Ca(OH)2 - малорастворимое основание, значит относится к электролитам dx-dy.ru Кулометр К является стандартным прибором для определения истинного количества электричества, прошедшего через систему. Правда, среднюю величину количества электричества можно определять из произведения силы тока / на время т. Серная кислота добавляется в электролит кулометра для увеличения электропроводности, спирт — для предотвращения реакции 2Си Си " " + [c.230] Б. Особенности электропроводности неводных растворов. В водных растворах, а также в неводных растворителях с высокой диэлектрической постоянной эквивалентная электропроводность обычно возрастает с ростом разведения (см. рис. 16) в результате увеличения подвижности ионов, а для слабых электролитов также и степ auto21rus.ru Кулометр К является стандартным прибором для определения истинного количества электричества, прошедшего через систему. Правда, среднюю величину количества электричества можно определять из произведения силы тока / на время т. Серная кислота добавляется в электролит кулометра для увеличения электропроводности, спирт — для предотвращения реакции 2Си Си " " + [c.230] Б. Особенности электропроводности неводных растворов. В водных растворах, а также в неводных растворителях с высокой диэлектрической постоянной эквивалентная электропроводность обычно возрастает с ростом разведения (см. рис. 16) в результате увеличения подвижности ионов, а для слабых электролитов также и степени диссоциации. Эта закономерность нарушается в неводных растворителях с низкой диэлектрической проницаемостью, что было впервые обнаружено в 1890 г. И. А. Каблуковым при исследовании растворов хлористого водорода в амиловом спирте. Электропроводность этих растворов возрастала с ростом концентрации (т. е. с уменьшением разведения) в определенном интервале. Такое явление называется аномальной электропроводностью. В растворителях с диэлектрической проницаемостью езависимости эквивалентной электропроводности от разведения можно наблюдать максимум и минимум (рис. 23). П. Вальден установил, что разведение, отвечающее минимуму электропроводности, и диэлектрическая проницаемость растворителя связаны соотношением e /v и 30. [c.77] Кулонометр К является стандартным прибором для определения истинного количества электричества, прошедшего через систему. Правда, среднюю величину количества электричества можно определять из произведения силы тока / на время т. Серная кислота добавляется в электролит кулонометра для увеличения электропроводности, спирт — для предотвращения реакции 2 u+->- u-+-l--f u. Перед работой медный катод кулонометра очищается наждачной бумагой и взвешивается на аналитических весах. Количество электричества рассчитывается по увеличению массы медного катода после окончания электролиза, причем выход по току в медном кулонометре принимается за 100%. [c.320] Так как электропроводность является легко измеряемым свойством растворителей, то значение ее можно применять для определения степени чистоты вещества в том случае, если в нем предполагается наличие проводящих ток примесей. В связи с этим измерение электропроводности часто производят для того, чтобы определять степень чистоты растворителя в процессе удаления из него примесей электролитов. В ходе очистки электропроводность растворителя стремится к постоянной минимальной величине. Таким методом можно определить чистоту таких растворителей, как воды для электропроводности , спирта, безводной уксусной кислоты и т. п. Ясно, что метод электропроводности пе применим для определения частоты растворителей, содержащих примеси неэлектролитов. [c.338] Электропроводность раствора H I в метиловом спирте почти в 4 раза меньше, чем в воде, что трудно объяснить уменьшением скорости движения ионов. Низкая электропроводность в неводных средах определяется в основном малой степенью диссоциации веществ в этих растворителях. Так, если хлористый водород в водном растворе диссоциирован полностью, то в спир-то шм растворе степень его диссоциации гораздо меньше единицы, а в бензоле он образует совсем слабый электролит. [c.439] Характер кипения жидкости и рост пузырьков существенно изменяется в электрическом поле [24, 26- 28]. Исследование теплопередачи при насыщенном кипении в электрическом поле частотой 50 Гц изолирующих (бензол, гексан, жидкий азот) и полярных (этиловый и метиловый спирты, деминерализованная вода и др.) жидкостей выявило увеличение коэффициентов теплоотдачи во всех режимах кипения, причем это увеличение было тем больше, чем больше электропроводность жидкости. [c.157] В окислительно-восстановительных реакциях важная роль принадлежит некоторым катализаторам, являющимся полупроводниками ( 55 ), причем между их каталитическим действием и электронно-физическими свойствами (энергетическими уровнями и работой выхода электрона) существует связь. Так, С. Я. Пшежецкий и И. А. Мясников показали, что существует отчетливая связь между электропроводностью окиси цинка и ее каталитической активностью в реакции дегидрогенизации изопропилового спирта с образованием ацетона. Это наблюдается и между каталитической активностью и температурой, и при сопоставлении результатов, полученных в атмосфере чистого азота, с результатами, получаемыми при добавлении к азоту 0,4% кислорода, сильно снижающего и электропроводность, и каталитическую активность окиси цинка в данном процессе. [c.498] Следовательно, относительно высокая электропроводность спиртовых рас-твсров в этом случае обусловлена сохранением, хотя и в меньшей степени, цепной, или эстафетной, проводимости как следствия сходного строения молекул воды и спирта и значительного сродства последних к протону. [c.443] О таком индивидуальном характере взаимодействия свидетельствуют прежде всего данные Вальдена, систематически исследовавшего электропроводность солей, т. е. сильных электролитов в ряду растворителей (спирты, кетоны, углеводороды, галоидоуглеводороды, эфиры, амины, нафтолы, нитро-замещенные и т. д.). Этими работами было показано, что поведение солей в различных растворителях зависит не только от диэлектрической проницаемости растворителя, как это следует из теории Фуосса и Крауса, но и от химической природы растворителя и соли. Вальден показал, что одинаково [c.9] Электропроводность любых электролитов, слабых и сильных, в сравнительно разбавленных растворах возрастает с разбавлением. Это является следствием либо увеличения степени диссоциации, либо увеличения подвижности ионов, либо того и другого. Однако при исследовании растворов хлористого водорода в амиловом спирте в 1890 г. И. А. Каблуков нашел так называемую аномальную электропроводность. Он установил, что при значительном увеличении концентрации (при уменьшении разбавления) электропроводность хлористого водорода в амиловом спирте не уменьшалась, а наоборот, возрастала (рис. 26). Это возрастание электропроводности не могло быть объяснено на основании теории Аррениуса, не может быть объяснено и на основании теории Дебая — Онзагера. [c.104] Через год В. П. Пашков (Харьковский университет) обнаружил также аномалию электропроводности иодистого кадмия и сулемы в растворах этилового спирта. Он впервые правильно объяснил эту аномальную электропроводность иодистого кадмия образованием комплексных соединений в растворах. [c.104] В жидких галогеноводородах вследствие их сильно выраженных протогенных свойств проявляют свои основные свойства спирты, альдегиды, кетоны, фенолы и слабые кислоты. В этих растворителях происходит перенос протона от растворителя к перечисленным растворенным веществам, чем обусловливается высокая электропроводность растворов. [c.282] Очень интересны наблюдения Каблукова относительно изменения силы кислот под влиянием растворителя. Измерив электропроводность спирто-водных растворов нескольких кислот, Каблуков нашел, что она измэняется неодинаково в зависимости от природы кислоты. Меньше всего изменяется электропроводность [c.60] При добавлении органического компонента, напрн-мер спирта, ацетона, мочевины, к водному раствору электролита электропроводность. последнего уменьшается. Сни)йение электропроводности обусловлено уменьшением диэлектрической проницаемости смеси, степени диссоциации электролита в смеси и концентрации воды в растворителе. [c.84] Динитроксилол может быть определен в присутствии большого избытка мононитроксилола. При этом образуется небольшая волна, соответствующая восстановлению первой нитрогруппы динитроксилола Ещ= —0,5 в), и большая растянутая волна, соответствующая восстановлению нитрогруппы мононитроксилола и второй нитрогруппы динитроксилола (Я1/2 от—1,11 до —1,65 в) при концентрации нитроксилола от 0,5 цо 8,0 ммоль1л (с поправкой Ещ = —0,2 в). Большая величина поправки объясняется малой электропроводностью спирто-бензольного раствора электролита. [c.441] Карбонцл никеля растворяется в карбониле железа, спирте, бензоле, хлороформе, ацетоее, толуоле, ксилоле, терпентииовых маслах, нефти, эфире и в других углеводородах. Смешиваясь со спиртом, карбонил никеля образует два слоя верхний — из спирта, насыщенного карбонилом, нижний — из карбонила, насыщенного спиртом. При растворении карбонила в спирте электропроводность его возрастает примерно в 10 раз. Электропроводность спирта, насыщенного карбонилом, составляет 3 10 ом [4 12, 36, 57, 117, 118, 122]. [c.202] Растворение KI и Nal в этиловом спирте, нагретом до температуры, превышающей его критическую, наблюдали И. Б Хен-ни и И. Хогарт [I. В. Наппу, I. Hogart, 1879, 1881 гг.]. При изотермическом снижении давления эти соли осаждались из паров и вновь растворялись при сжатии. Интересные опыты были проведены П. Виллардом (1896 г.), растворившим парафин, иод и камфару в метане, сжатом до 150—200 кгс/см. При понижении давления парафин выделялся в виде чешуек, а камфара кристаллизовалась на стенках трубки. Е. Франклин и К. Краус в 1900 г. обнаружили, что электропроводные растворы ряда солей в жидком аммиаке оставались проводящими и при температуре выше критической температуры растворителя. [c.5] Представления об образовании ионных атмосфер в растворах электролитов, нашедшие отражение в теории Дебая — Хюккеля, объяснили многие свойства электролитных растворов. Однако ряд экспериментальных фактов не объяснялся этой теорией. Непонятной была, например, аномальная электрическая проводимость, впервые обнаруженная Каблуковым (1890) при исследовании растворов НС1 в амиловом спирте. Обычно удельная электропроводность концентрированных растворов уменьшается с добавлением электролита. Каблуков нашел, что начиная с некоторой высокой концентрации электрическая проводимость раствора НС1 в амиловом спирте с дальнейшим ростом концентрации не уменьшалась, а возрастала. Впоследствии такого рода концентрационная зависимость электрической проводимости была обнаружена во многих других системах, включая водные растворы (например, растворы AgNOa). [c.445] Зельц и Мак-Кинней [201] проводили титрование минеральных масел, растворенных в амиловом спирте, с хингидратным электродом, причем амиловый спирт для увеличения электропроводности насыщали хлористым литием. [c.453] Пропилсерная кислота. Попыток выделить свободную н-про-пилсерную кислоту, повидимому, не делалось. Калиевая соль [216] приготовлена обычным путем из реакционной смеси, полученной взаимодействием к-пропилового спирта и серной кислоты. Изучены оптические свойства кристаллической соли [217]. Электропроводность растворов натриевой соли и свободной кислоты [218] указывает на то, что эти соединения сильно ионизированы. [c.43] О свойствах высокомолекулярных сульфокислот можно получить представление после ознакомления со свойствами 1-гексаде-кансульфокислоты [246], более детально изложенными ниже. Свободную кислоту трудно выделить в чистом виде из растворов воды и спирта, из эфира же она кристаллизуется в виде белого твердого вещества, плавящегося при53—54 . Кислота трудно растворима в воде при комнатной температуре, но легко растворяется при температуре выше 50 . В обычных органических растворителях она хорошо растворяется при комнатной температуре 0,0008 н. водный раствор ее имеет легкую муть, в то время как 0,3 н. раствор представляет собой очень вязкую желатинообразную массу. При 90 растворы прозрачны даже после длительного стояния. Вязкость 1,0 н. раствора при 90 так велика, что пузырьки водорода проходят через него очень медленно [246]. Степень диссоциации, найденная путем измерения электропроводности, составляет около 25% для 0,1 п., 85% для 0,0001 н. и 30% для 0,5 н. водного раствора, что напоминает поведение натриевого и калиевого мыл. Степень диссоциации нри 90 , вьгчисленная из значений электропроводности, понижения упругости пара и измерений электродвижущей силы, составляет соответственно 29,8, 38,4 и 63%. Детальная сводка этих результатов сделана в работе Мак-Вэна и Вильямса [246]. Кондуктометрическое титрование [c.126] Примером синтеза прямой конденсацией может служить получение золя ртути. Для этого Нордлунд пропускал пары ртути через слой воды и. получал довольно высокодисперсную эмульсию ртутц в воде. Аналогичным способом могут быть получены золн серы, селена и теллура. Путем конденсации в жидкости паров меди, серебра, золота и платины,. полученных в вольтовой дуге, можно получить соответствующие золи в воде, спиртах, глицерине или бензоле. Строение мицелл этих золей мало изучено. Стабилизатором при получении всех этих систем служат окислы веществ, получающиеся при соприкосновении их паров с воздухом при высокой температуре. Образование в таких условиях окислов, обладающих свойствами электролитов, подтверждается заметным возрастанием электропроводности системы. Однако более стойкие-золи получаются в том случае, если в воду, в которой происходит конденсация паров, вводят стабилизующие электролиты. [c.245] Разработанные металлоуглеродные волокна имеют следующие характеристики плотность - 1.6-2.2 г/см , прочность на разрыв - 200 - 1000 МПа, электропроводность - 10 -Ю Ом м, удельную намагниченность - 15 - 50 Гс см /г, обладают высокой адсорбционно-каталитической активностью в реакциях превращения циклических углеводородов, дегидрирования вторичных спиртов, окисления Нг, СО, хемосорбируют h3S, NHj. повышают физико-механические показатели композиционньге материалов в 1,2-2 раза. [c.182] МЕЛАМИН зHaNJ — бесцветные кристаллы, т. пл. 354 С малорастворим в воде, спирте. В большинстве органических растворителей нерастворим. Аминогруппы придают М. основные свойства. В промышленности М. получают из дн-циандиамида или из мочевины. М. применяют, главным образом, в производстве пластмасс, лаков, клеев, отличающихся высокой механической прочностью, малой электропроводностью, водо- и термостойкостью. В текстильной промышленности М. используется для изготовления не-мнущихся и безусадочных тканей в бумажной — для производства водонепроницаемой бумаги в деревообрабатывающей — для склеивания древесины, получения лаковых покрытий. Кроме того, М. применяется для приготовления ионообменных смол, дубильных веществ и др. [c.158] Целью настоящей работы является установление характера зависимости удельной электропроводности раствора электролита от концентрации неэлектролита, диэлек рической проницаемости раствора и предельной высокочастотной электропроводности растворителя. Значительный интерес представляет изучение этих зависимостей для водно-органических смесей, диэлектрическая проницаемость которых уменьшается (вода — спирт, вода — ацетон) и увеличивается (вода—мочевина, вода тпомочевина) с ростом крнцентрации неэлектролита. [c.84] Образование ионных пар в растворах проявляется в отклонении от линейности экспериментальной зависимости Я от с /г, соответствуюш ей закону Кольрауша и теории Дебая — Онзагера для полностью диссоциированных электролитов. Такое отклонение от линейности и наличие минимума на кривой зависимости Я от с г получпло название аномальной электропроводности и впервые было установлено в 1890 г. И. А. Каблуковым при изучении растворов хлорида водорода в амиловом спирте. [c.179] Ассоциация ионов в растворах. Если раствор электролита содержит достаточно большое количество ионов, то между ними возникает электростатическое взаимодействие, влияющее на свойства раствора. Еще в 1890 г. И. А. Каблуковым было обнаружено явление аномальной электропроводности. Обычно с увеличением разведения в растворах слабых и сильных электролитов увеличивается как степень диссоциаций, так и подвижность ионов, т. е. увеличивается электропроводность при уменьшении концентрации электролита. Однако при исследовании растворов хлористого водорода в амиловом спирте И. А. Каблуков обнаружил аномальное увеличение электропроводности раствора при значительном повышении концентрации НС1. Позже этот факт был объяснен обра-зованием сложных комплексных ионов, растворы которых хорошо проводят электрический ток. Таким образом, для растворов характерно не только явление диссоциации, но и обратное ему явление ассоциации — соединение ионов друг с другом, а также ионов с молекулами растворенного вещества. [c.231] Электрокинетические явления широко используются не только при научных исследованиях, но и в технике. В частности, электрофорез применяют для нанесения тонкого слоя частиц коллоидных размеров на поверхность проводящего материала. Этим способом лолучают весьма однородные покрытия, толщину которых легко регулировать. Электроотложение можно проводить в таких сре-, дах, как спирт, ацетон и других, что исключает выделение газов на электродах даже при большой силе тока и малой электропроводности жидкости. Для нанесения токопроводящих покрытий электрофорез используют при производстве изолированных нагревательных сниралей и активированных катодов для радиоламп, представляющих собой металлическую проволоку, покрытую тонким слоем окисла щелочноземельного металла. [c.218] К красителям, проявляющим в растворах все особенности, свойственные растворам коллоидных ПАВ, относится ряд синтетических красителей, например, бензопурпурин, ночной голубой и т. д. Ионогенными группами у коллоидных красителей служат карбоксильные группы, фенольные группы, сульфо-группы, аминогруппы и т. д. Растворы этих красителей сходны с растворами высокомолекулярных соединений — они обладают сравнительно высокой агрегативной устойчивостью, а образующийся при введении электролитов осадок способен диспергироваться в чистой воде. Растворы этих красителей проявляют такие же аномалии в отнощении электропроводности и осмотического давления, как и растворы мыл и таннидов. С. М. Липатов показал, что благодаря большому размеру молекул красителей ассоциация в растворах протекает значительно в большей степени, чем в растворах мыл, и весьма сильно зависит от концентрации, температуры, pH системы, присутствия электролитов и других факторов. Как и мыла, многие красители, дающие коллоидные растворы в воде, в спирте обра зуют молекулярные растворы. [c.415] Проволока реохорда неравномерно истирается во времени. Ее периодически калибруют. Точность измерений увеличивают удлинением проволоки до нескольких метров. Чтобы сделать установку более компактной, проволоку наматывают на барабан. При повороте барабана контакт в виде колесика скользит вдоль проволоки. Состояние контакта между колесиком и проволокой следует проверять. Движок во время измерений должен находиться в средней части проволоки, а не у ее концов. Проволоку реохорда перед работой слегка протирают неворсистой салфеткой и время от времени промывают этиловым спиртом ни в коем случае не чистят наждачной бумагой Реохорд может быть заменен двумя магазинами сопротивлений. Тогда в установке для копдуктометрических измерений будут датчик электропроводности с Ях и три магазина сопротивлений, при помощи которых вводят сопротивления Н, Я2 и Кг. Сопротивления и / з могут принимать любые значения, но сумма К2 + Яъ должна быть величиной постоянной. Если уменьшить на АЯ, то на столько же надо увеличить Я , и наоборот, что равнозначно передвижению движка по проволоке реохорда. [c.98] Подобные соотношения имеются для таких растворителей, как нитробензол (е = 34,5), ацетон (е = 19), пиридин (е = 12,5). В этой группе растворителей со сравнительно высокой диэлектрической проницаемостью многие соли хорошо диссоциированы, но многие становятся мало диссоциированными. В ряде спиртов и в воде различные по своей природе соли ведут себя примерно одинаково, а в растворителях, не содержащих гидроксильную группу (в нитрометапе, нитробензоле, пиридине и т. д.), различно. На основании этого Вальден классифицировал растворители на нивелирующие, в которых соли хорошо и примерно одинаково диссоциированы, и дифференцирующие, в которых соли резко различаются своими коэффициентами электропроводности. В дальнейшем оказалось, что на такие же группы можно разбить растворители не только по влиянию их на свойства солей, но и по влиянию на свойства кислот и оснований. [c.109] В 1921—1923 гг. Гольдшмидт определил изменение электропроводности растворов сильных кислот в спиртах с небольшими добавками воды. По изменению электропроводности он оценил константу равновесия между ионами этоксония и гидроксония. [c.201] Константы диссоциации кислот в спиртах (метиловом, этиловом, бутиловом, этилен-гликоле и др.) исследовались различными методами по электропроводности — константы изучали Гольдшмидт с сотрудниками, Хант и Бриско и др. по данным э. д. с. — Ларсен [c.275] chem21.info Вещества, распадающиеся на ионы в растворах или расплавах и потому проводящие электрический ток, называются электролитами. Примерами электролитов могут служить растворы кислот, солей и оснований. Например NaCl, HCl, h3SO4, NaOH. Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами. Например органические соединения, сахар, бензин, спирт, ацетон. константан-электролит вода и дистиллированная вода ) Электролиты это все соли, которые при растворении в воде распадаются на ионы и проводят эл. ток ( соль, сода, кислоты серная, солянная, щелочи) . Соответственно не электролиты, это те, которые при растворении в воде не распадаются на ионы и не проводят эл. ток. ( сахар) электролиты HBr KOH h3SO4 touch.otvet.mail.ru Диалкокси-2,5-дигидрофураны можно получить электролитическим окислением фурана в спиртовом растворе бромистого аммония или окислением фурана бромом в соответствующем спирте. [c.46] Состав анолита. Подобно процессу восстановления, протекание электролитического окисления может зависеть от анолита. В кислом растворе анилин окисляется до черного анилина, в то время как в щелочном растворе главным продуктом окисления является азобензол. Низшие спирты окисляются в кис-.дом растворе до альдегидов и кислот в щелочном же растворе, помимо альдегидов и кислот, образуется также анодный водород (см. стр. 342 в работе [15]). [c.346] Необратимые процессы [3]. Реакции необратимого типа, т. е. реакции в системах, в которых не устанавливаются обратимые равновесные потенциалы, наиболее часто встречаются в случае органических соединений, не диссоциирующих на ионы. Катодное восстановление нитробензола в анилин и анодное окисление спирта в уксусную кислоту являются примерами процессов этого типа. Вероятно, необратимы также некоторые неорганические реакции, например электролитическое восстановление азотной кислоты и нитратов в гидроксиламин и аммиак или анодное окисление ионов трехвалентного хрома в хромат-ионы. Хотя проблемы электролитического окисления и восстановления были предметом многочисленных экспериментальных исследований, точный механизм протекающих при этом реакций остается все еще спорным. Так, например, электролитическое восстановление соединения НО в К может быть представлено уравнением [c.672] Электролитическое окисление. Потенциал электрода. В присутствии деполяризатора на аноде трудно бывает получить устойчивые потенциалы любой желаемой величины. Как общее правило, потенциал анода быстро растет от низкого значения, при котором анод растворяется, до высокого значения, отвечающего пассивному состоянию анода и выделению кислорода. Однако, так как платиновый электрод почти всегда пассивен, иа нем можно в ограниченных пределах изменять потенциал. Данные, приведенные в табл. 86, были получены при окислении кислого раствора этилового спирта на платиновом аноде при разных потенциалах [7]. Как видно из этих данных, по мере возрастания анодного потенциала процент содержания уксусной кислоты в продуктах окисления увеличивается. [c.679] Как указывалось ранее, большинство процессов электролитического окисления или восстановления органических соединений протекает необратимо. Имеются, однако, некоторые заслуживающие внимания исключения, например переход хинона в гидрохинон, лейкооснования в окрашенную форму трифенилметановых красителей и т. д. Однако эти системы редки, и в общем случае мы должны довольствоваться эмпирическими данными. Необратимая система не дает определенного потенциала, который изменялся бы в соответствии с количеством окисленной и восстановленной формы, как это получается в случае применения термодинамического выражения для потенциала обратимой системы. Потенциал необратимых систем зависит больше от природы среды (степени ее кислотности или щелочности) и природы электрода, чем от концентраций окисленной и восстановленной форм. Поэтому невозможно применить простые термодинамические принципы, которые справедливы для обратимых электродных процессов. Следует помнить, что существует четкое различие между химической и термодинамической обратимостью. Переход кетона во вторичный спирт может быть обратимым, но этому равновесному переходу не обязательно будет соответствовать определенный термодинамически обратимый потенциал. Это не означает, что кетон, электролитически восстановленный до спирта, не может быть снова электролитически окислен до кетона. Такое окисление возможно, но для осуществления его потребуются совершенно другие условия в отношении потенциала, pH среды и. материала электрода. [c.12] Известен также способ получения янтарной кислоты путем электролитического окисления фурфурола [70] или тетрагидрофурфурилового спирта [71] в разбавленном растворе кислот или солей. [c.63] Механизм процесса электролитического окисления бутиролактона и тетрагидрофурфурилового спирта изучался японскими исследователями [89]. Янтарную кислоту получали с хорошим выходом при использовании свинцового катода и анода из двуокиси свинца. [c.66] Из других процессов электролитического окисления кроме описываемого ниже производства перекисей отметим получение хромовокислых солей, многочисленных органических соединений (окисление спиртов до кислот) и т. д. [c.448] При проведении электролитического восстановления многие органические соединения можно перевести в водный раствор добавлением к католиту определенных количеств какого-нибудь растворимого органического соединения, например одного из низших спиртов, обычно этилового (см. примеры реакций восстановления, стр. 332 и сл.). Если эту операцию осуществить при проведении окисления, то соединение, добавляемое для повышения растворимости, окисляется вместе с тем органическим соединением, которое нужно окислить. В некоторых случаях, как указано выше, можно употреблять неводные рас- [c.324] Нами изучено окисление этилового спирта на Pt-черни. В каждом опыте использовали 0,1 г платины. Навеска спирта 0,77 мл (0,616 г) эквивалентна поглощению 300 мл кислорода при окислении до кислоты. Применяли электролитический кислород. Растворитель — 30 мл бидистиллята. Перед началом опыта катализатор насыщали кислородом до установления потенциала, близкого к обратимому кислородному (величина э.д.с. при обратимом кислородном потенциале равна 659 мв по 0,1 н. окисно-ртутному электроду при pH 7). После введе- [c.429] Окисляемость реактивных топлив мы оценивали в приборе ЛСА. Топлива окисляли кислородом воздуха в присутствии металлического катализатора (пластинки из электролитической меди) при 110° С. Критерием оценки служило образование в топливе за 8—10 ч окисления потенциальных смол, нерастворимых в топливе смол (но растворимых в полярных растворителях — спирто-бензольной смеси) и осадка (нерастворимого и в полярных растворителях) [12, 13]. [c.259] Из этого уравнения видно, что 70% иода не используется в процессе. Этот иод может быть регенерирован путем окисления его хлором или раствором гипохлорита до свободного иода, который вновь возвращается в процесс. Практическая целесообразность такого процесса сомнительна. В электролитическом процессе среда состоит из щелочного раствора спирта, содержащего иодистый калий. Пропускаемый ток служит только для разряда ионов иода на аноде, так как измерения потенциала показывают, что этиловый спирт не является деполяризатором при этих условиях [41]. Суммарный процесс на аноде можно выразить следующим образом [c.163] Неэлектролиты, подобные ацетону и спиртам, могут быть деионизованы методом, который используется для воды. Эти методы применимы к почти безводным органическим жидкостям и их водным растворам. В первом случае ионы поглощаются смолой медленнее, чем из водных растворов. Концентрация неэлектролитов в начальных порциях фильтрата из ионообменной колонки может отличаться от исходной, так как смолы в присутствии воды могут их сорбировать. Основная электролитическая примесь в низших первичных спиртах и в водном растворе формальдегида — кислота, образовавшаяся в результате окисления этих веществ атмосферным кислородом. Чтобы удалить кислоту, во многих случаях достаточно пропустить раствор через колонку анионообменника в ОН -форме. Так как сильноосновная смола катализирует полимеризацию формальдегида, для удаления кислоты из формальдегида применяется только слабоосновная смола [1а]. [c.90] Полярографически неактивные вещества можно обнаружить в том случае, если ввести в испытуемое соединение активную группировку. Например, для обнаружения примеси метилового спирта в этиловом было предложено окислять пробу спирта хромовой смесью или электролитическим путем, при этом метиловый спирт образует формальдегид, а этиловый—уксусный альдегид. На полярограмме окисленной пробы в случае присутствия даже минимальных следов метилового спирта в исходном этиловом образуются две четкие волны, первая из которых обусловлена формальдегидом. В отсутствие метанола на полярограмме обнаруживается только одна волна, соответствующая уксусному альде- [c.37] Исходным материалом для сухозаряженных цинковых электродов может быть электролитический порошок цинка, тщательно отмытый и высушенный в условиях, исключающих его окисление. Подобный порошок получается электролизом цинкатных растворов в виде губчатого осадка на никелевых или никелированных катодах [Л. 9]. К высушенному цинковому порошку, содержащему около 90%, металлического цинка, добавляется 1,0—1,5% НдО для замедления саморазряда электрода в щелочном электролите. Порошкообразная масса без специального связующего вещества напрессовывается под давлением около 50 кГ/см на медный токоотвод. В качестве оболочки цинкового электрода используется пленка поливинилового спирта, которая в отличие от целлофана не подвергается разрушающему воздействию ионов куприта. [c.209] Старые методы получения хлороформа состояли в электролизе разбавленного спиртового раствора хлоридов щелочных металлов, причем главным образом происходило окисление спирта, а хлороформ получался в небольшом количестве как побочный продукт 8]. Такой результат не является неожиданным, учитывая, что кислород в щелочной среде выделяется при значительно более низком потенциале, чем в кислой среде. Некоторое увеличение выхода было достигнуто в водном растворе хлористого кальция при плотности тока 0,08 а см и температуре 50—70° [9]. В этом случае щелочность среды регулируется в результате осаждер.ия гидроокиси кальция. Однако при этом возникает то затруднение, что образующаяся гидроокись кальция, осаждаясь на электроде, препятствует прохождению тока. Весьма тщательное изучение условий электролитического получения хлороформа было проведено Фейером [10]. Применяя платиновый анод, плотность тока примерно I а см и нейтрализующий катод по методу Роуша [11] в среде, содержащей 20% раствор хлористого калия, удалось получить хлороформ с выходом по току 65—75%. Этот метод оказался пригодным как для превращения этилового спирта, так и ацетона. Однако при использовании этилового спирта требуется температура около 30°, в то время как для ацетона желательна температура около 15°. Далее, Фейер установил, что можно полу- [c.155] К процессам электролитического окисления следует отнести также процессы хлорирования, фторирования, бромирования и иодирования на аноде. Такие реакции применяются главным образом при электросинтезе органических соединений, например, для хлорирования бензола или этилена, фторирования и бромирования углеводородов, получения йодоформа. Теория этих процессов изучена очень мало Изгарышев и Горбачев считают, что первично на аноде выделяется галоид, который уже вторично взаимодействует с веществом, подлежащим галоидированию (бензол, толуол, спирт и т. д.) непосредственно или с промежуточным образованием в водных растворах хлорноватистых, иодноватистых и других соединений. Очевидно, электрогалоидирование в ряде случаев должно идти аналогично электроокислению. [c.119] Средства окисления углеводородов — не совсем обычны таковы, например, электролитическое окисление в растворах Н2504, токн. Тесла, бихромат или КМп04 с Н2504, Оз и т. д. Наоборот, окисление фенолов проходит легко их окисление до образования смолы часто представляет нежелательный побочный процесс, например, при использовании крезола для адсорбции летучих растворителей (ацетон, спирт и т. д.) [c.580] Состав анолита. Подобно восстановлению, направление электролитического окисления может зависеть от анолита. Анилин окисляется до черного анилина в кислом растворе, в то время как в щелочйом растворе главным продуктом является азобензол. Низшие спирты в кислом растворе окисляются до альдегидов и кислот в щелочном растворе, помимо альдегидов и кислот, образуется также и анодный водород. [c.50] Через стадию образования акролеина протекает также окисление аллилового спирта воздухом на платиновом контакте [1888] или электролитическое окисление в среде серной кислоты [1884]. В обоих случаях (особенно в нервом) выход акриловой кислоты низкий. В противоположность этому каталитическое окисление металлилового спирта воздухом на топкоразмель-ченной меди протекает исключительно благоприятно [1888а]. [c.396] При восстановлении, в ряде случаев, частично образуется уран (III), который легко и быстро окисляется до урана (IV) кислородом воздуха. Уран (VI) можно количественно восстановить до урана (IV) электролитически на ртутном катоде [8, 260, 861], фотохимически спиртом [829], эфиром [833], или молочной кислотой [828] в азотнокислом растворе уран (IV) можно получить восстановлением уранил-нитрата ронгалитом [57] удобным восстановителем урана (VI) до урана (IV) является двуокись тиомочевины (Nh3)2 S02[48,48а] и гидросульфит натрия Na2S204[8, 184]. Кислые растворы четырехвалентного урана довольно устойчивы в темноте и на холоде [8]. Показано, что окисление урана (IV) воздухом су-ш.ественно ускоряется под влиянием света, особенно прямого солнечного или ультрафиолетового [263] при этом процесс окисления протекает следующим образом [c.28] Материал анода. Согласно имеющимся данным, единственным анодным материалом для электролитического тио- и селеноцианирования является уголь. Для галогенирования (как прямого, так и непрямого) в водном растворе применяли гладкую платину. В метиловом спирте использовали также уголь, а в случае фторирования—никель. При окислении гипобромитом и для реакций присоединения применяли угольные аноды. [c.348] Коэл [49] показал, что при электролизе с угольными анодами продуктов реакции Кольбе не образуются даже кислоты, не содержащие заместителей в а-положении. Окисление ацетата, пропионата и бутирата он рассматривает как двухэлектронную электрохимическую реакцию, включающую потерю двуокиси углерода и образование горячего карбониевого иона, который может либо элиминироваться с образованием олефинов, либо гидрироваться кроме того, возможна также миграция метильной группы, в результате чего образуются более устойчивые промежуточные продукты, которые затем образуют олефины или продукты замещения. Коэл отметил, что смеси, получающиеся после электролитического генерирования карбониевых ионов, обычно отличаются от смесей, получающихся при дезаминировании аминов или восстановлении спиртов. Он объяснил это большей энергией электролитически генерированных ионов. Очевидная зависимость результатов реакции от метода генерирования карбониевых ионов отмечалась выше при обсуждении образования бицикло[3,1,0]гексил-иона [42]. [c.145] Непрямое окисление этилена в уксусную кислоту может быть осуществлено превращением его в эт)4ловый спирт (см. гл. 13), который затем окисляется в эфир уксусной кислоты 1) электролитически, 2) хромовой кислотой или перманганатом калия или 3) воздухом Stra he описал метод, в котором ненасыщенные углеводороды, получаемые из различных источников, этерифицируются минеральной кислотой, например серной, а затем окисляются бихроматом ка.шя. Летучие кислоты могут быть отделены от остальных продуктов перегонкой с водяным паром. [c.1004] Надсерная кислота и ее соли, получаемые электрохимическим методом путем окисления серной кислоты или сульфатов на аноде, являются полупродуктами в производстве перекиси водорода. До начала 50-х годов производство перекиси водорода основывалось преимущественно на гидролизе электролитических надсерной кислоты и ее солей. В настоящее время лишь 36% мирового производства перекиси водорода базируется на переработке надсерной кислоты и персульфатов, 56% Н2О2 производится химическим методом через антрахинон, 8% получается через изопропиловый спирт 1265]. В СССР электрохимический метод является основным с его помощью производится 80% всей перекиси водорода [3]. [c.79] Другим типом весового кулонометра является медный, показанный на рис. 11. Медный кулонометр представляет собой прямоугольный стеклянный сосуд, на двух противоположных стенках которого подвешены пластины из электролитической меди, служащие анодами, а между ними помещена тонкая медная пластина, служащая катодом. В качестве электролита используют водный раствор, содержащий сульфат меди uS04-5h30 (125—150 кг/м ), серную кислоту h3SO4 (50 кг/м ) и этиловый спирт. Добавка этилового спирта в раствор предотвращает возможность окисления выделяющейся на катоде меди. [c.46] chem21.info Изобретение относится к спиртовым топливным элементам прямого действия, использующим твердые кислотные электролиты и катализаторы внутреннего риформинга. Техническим результатом изобретения является повышенные удельная мощность и напряжение элемента. Согласно изобретению топливный элемент включает анод, катод, твердый кислотный электролит, газодиффузионный слой и катализатор внутреннего риформинга. Катализатор внутреннего риформинга может составлять любой подходящий риформер и он располагается по соседству с анодом. В данной конфигурации тепло, генерируемое в экзотермических реакциях на катализаторе в топливном элементе, и омическое нагревание электролита топливного элемента являются движущей силой для эндотермической реакции риформинга топлива, преобразующей спиртовое топливо в водород. Возможно использование любого спиртового топлива, например, метанола или этанола. 5 н. и 20 з.п. ф-лы, 4 ил.
Область техники Изобретение относится к спиртовым топливным элементам прямого действия, использующим твердые кислотные электролиты. Уровень техники Спирты недавно были подвергнуты интенсивным исследованиям в качестве потенциальных топлив. В особенности желательными в качестве топлив являются спирты, такие как метанол и этанол, поскольку они характеризуются удельными энергиями, в пять-семь раз превышающими соответствующие характеристики для стандартного сжатого водорода. Например, один литр метанола энергетически эквивалентен 5,2 литра водорода, сжатого до 320 атм. Кроме того, один литр этанола энергетически эквивалентен 7,2 литра водорода, сжатого до 350 атм. Желательными такие спирты являются также и потому, что они просты в обращении, хранении и транспортировке. Метанол и этанол являлись предметом многих исследований с точки зрения спиртового топлива. Этанол можно получать в результате ферментации растений, содержащих сахар и крахмал. Метанол можно получать в результате газификации древесины или отходов древесины/зерновых растений (соломы). Однако более эффективным является синтез метанола. Данные спирты, помимо прочего, являются возобновляемыми ресурсами и поэтому они предположительно играют важную роль как в уменьшении выделения газов, вызывающих парниковый эффект, так и в уменьшении зависимости от ископаемых топлив. Топливные элементы были предложены в качестве устройств, превращающих химическую энергию таких спиртов в электрическую энергию. В этом отношении интенсивным исследованиям были подвергнуты спиртовые топливные элементы прямого действия, имеющие мембраны из полимерного электролита. Говоря конкретно, исследованиям были подвергнуты метанольные топливные элементы прямого действия и этанольные топливные элементы прямого действия. Однако исследования этанольных топливных элементов прямого действия проводились ограниченно вследствие относительной трудности окисления этанола в сопоставлении с окислением метанола. Несмотря на данные усилия в проведении обширных исследований эксплуатационные характеристики спиртовых топливных элементов прямого действия остаются неудовлетворительными главным образом вследствие кинетических ограничений, налагаемых электродными катализаторами. Например, типичные метанольные топливные элементы прямого действия характеризуются удельной мощностью, равной приблизительно 50 мВт/см2. Были получены и более высокие уровни удельной мощности, например 335 мВт/см2, но только в чрезвычайно суровых условиях (Nafion®, 130°C, кислород 5 атм и метанол 1 М для расхода 2 куб. см/мин при давлении 1,8 атм). Подобным же образом этанольный топливный элемент прямого действия характеризуется удельной мощностью 110 мВт/см2 при подобных чрезвычайно суровых условиях (Nafion® - диоксид кремния, 140°С, анод 4 атм, кислород 5,5 атм). В соответствии с этим существует потребность в спиртовых топливных элементах прямого действия, характеризующихся высокими удельными мощностями в отсутствие таких экстремальных условий. Краткое изложение изобретения Настоящее изобретение относится к спиртовым топливным элементам, содержащим твердые кислотные электролиты и использующим катализатор внутреннего риформинга. Топливный элемент в общем случае включает анод, катод, твердый кислотный электролит и внутренний риформер. Риформер обеспечивает прохождение риформинга спиртового топлива с получением водорода. Движущей силой реакции риформинга является тепло, генерируемое в ходе экзотермических реакций в топливном элементе. Использование твердых кислотных электролитов в топливном элементе делает возможным размещение риформера непосредственно по соседству с анодом. Ранее это не считалось возможным вследствие повышенных температур, требуемых для эффективного функционирования известных материалов риформинга, и чувствительности к воздействию тепла у типичных мембран из полимерного электролита. Однако в сопоставлении с обычными мембранами из полимерных электролитов твердые кислотные электролиты могут противостоять воздействию намного более высоких температур, что делает возможным размещение риформера по соседству с анодом и поэтому поблизости от электролита. В данной конфигурации отходящее тепло, генерируемое электролитом, поглощается риформером и служит движущей силой эндотермической реакции риформинга. Краткое описание чертежей Данные и другие признаки и преимущества настоящего изобретения будет лучше поняты после ознакомления со следующим далее подробным описанием, рассматриваемым в сочетании с прилагаемыми чертежами, где: Фигура 1 представляет собой схематическое изображение топливного элемента, соответствующего одному варианту реализации настоящего изобретения; Фигура 2 представляет собой графическое сопоставление кривых зависимостей между удельной мощностью и напряжением элемента для топливных элементов, полученных в соответствии с примерами 1 и 2 и сравнительным примером 1; Фигура 3 представляет собой графическое сопоставление кривых зависимостей между удельной мощностью и напряжением элемента для топливных элементов, полученных в соответствии с примерами 3, 4 и 5 и сравнительным примером 2; и Фигура 4 представляет собой графическое сопоставление кривых зависимостей между удельной мощностью и напряжением элемента для топливных элементов, полученных в соответствии со сравнительными примерами 2 и 3. Подробное описание изобретения Настоящее изобретение относится к спиртовым топливным элементам прямого действия, содержащим твердые кислотные электролиты и использующим катализатор внутреннего риформинга, находящийся в физическом контакте с мембранно-электродным агрегатом (МЭА), предназначенным для проведения риформинга спиртового топлива с получением водорода. Как отмечалось выше, эксплуатационные характеристики топливных элементов, которые превращают химическую энергию в спиртах непосредственно в электрическую мощность, остаются неудовлетворительными вследствие кинетических ограничений, обусловленных электродными катализаторами топливных элементов. Однако хорошо известно, что данные кинетические ограничения значительно уменьшаются в случае использования водородного топлива. В соответствии с этим в настоящем изобретении используют катализатор риформинга или риформер, предназначенные для проведения риформинга спиртового топлива с получением водорода, тем самым обеспечивая уменьшение или устранение кинетических ограничений, связанных со спиртовым топливом. Спиртовые топлива подвергают паровому риформингу в соответствии со следующими далее примерами реакций: Метанол в водород: СН3ОН+Н2O→3Н2+СО2; Этанол в водород: C2H5OH+3Н2О→6h3+2CO2. Однако реакция риформинга является сильно эндотермичной. Поэтому для получения движущей силы реакции риформинга риформер необходимо нагревать. Требуемое количество тепла обычно составляет приблизительно 59 кДж на один моль метанола (эквивалентно сжиганию приблизительно 0,25 моль водорода) и приблизительно 190 кДж на один моль этанола (эквивалентно сжиганию приблизительно 0,78 моль водорода). В результате прохождения электрического тока во время эксплуатации топливных элементов происходит генерация отходящего тепла, эффективное удаление которого оказывается проблематичным. Однако генерация данного отходящего тепла делает размещение риформера непосредственно рядом с топливным элементом естественным вариантом при выборе. Такая конфигурация делает возможными подачу водорода из риформера в топливный элемент и охлаждение топливного элемента и позволяет топливному элементу нагревать риформер и формировать движущую силу для реакций в нем. Такая конфигурация используется в топливных элементах на основе расплавленных карбонатов и для реакций риформинга метана, проходящих при температуре, приблизительно равной 650°С. Однако реакции риформинга спирта в общем случае протекают при температурах в диапазоне от приблизительно 200°С до приблизительно 350°С, и до сих пор еще не было разработано никакого подходящего топливного элемента с использованием риформинга спирта. Настоящее изобретение относится к такому топливному элементу с использованием риформинга спирта. Как проиллюстрировано на ФИГУРЕ 1, топливный элемент 10, соответствующий настоящему изобретению, в общем случае включает первый токосъемник/газодиффузионный слой 12, анод 12а, второй токосъемник/газодиффузионный слой 14, катод 14а, электролит 16 и катализатор внутреннего риформинга 18. Катализатор внутреннего риформинга 18 располагают по соседству с анодом 12а. Говоря более конкретно, катализатор риформинга 18 располагают между первым газодиффузионным слоем 12 и анодом 12а. Возможно использование любого известного подходящего катализатора риформинга 18. Неограничивающие примеры подходящих катализаторов риформинга включают смеси оксидов Cu-Zn-Al, смеси оксидов Cu-Co-Zn-Al и смеси оксидов Cu-Zn-Al-Zr. Возможно использование любого спиртового топлива, такого как метанол, этанол и пропанол. В дополнение к этому в качестве топлива возможно использование диметилового эфира. Исторически данная конфигурация не считалась возможной для спиртовых топливных элементов вследствие эндотермической природы реакции риформинга и чувствительности электролита к воздействию тепла. В типичных спиртовых топливных элементах используют мембраны из полимерного электролита, которые не могут выдерживать воздействие тепла, необходимого для создания движущей силы для катализатора риформинга. Однако электролиты, используемые в топливных элементах настоящего изобретения, содержат твердые кислотные электролиты, такие как те, что описываются в патенте США №6468684, озаглавленном PROTON CONDUCTING MEMBRANE USING A SOLID ACID, полное содержание которого включается в настоящий документ для справки, и в одновременно находящейся на рассмотрении патентной заявке США с регистрационным номером 10/139043, озаглавленной PROTON CONDUCTING MEMBRANE USING A SOLID ACID, полное содержание которой также включается в настоящий документ для справки. Одним неограничивающим примером твердой кислоты, подходящей для использования в качестве электролита в настоящем изобретении, является Csh3PО4. Твердые кислотные электролиты, используемые в случае топливных элементов данного изобретения, могут выдерживать воздействие намного более высоких температур, что делает возможным размещение катализатора риформинга непосредственно по соседству с анодом. Кроме того, эндотермическая реакция риформинга потребляет тепло, генерируемое в экзотермических реакциях в топливном элементе, формируя термически сбалансированную систему. Данные твердые кислоты используются в своих суперпротонных фазах и выступают в роли протонопроводящих мембран в температурном диапазоне от приблизительно 100°С до приблизительно 350°С. Верхний край данного температурного диапазона идеален для риформинга метанола. Для обеспечения генерации тепла в степени, достаточной для формирования движущей силы для реакции риформинга, и для обеспечения протонной проводимости твердого кислотного электролита топливный элемент настоящего изобретения предпочтительно эксплуатируют при температурах в диапазоне от приблизительно 100°С до приблизительно 500°С. Однако более предпочтительно топливный элемент эксплуатировать при температурах в диапазоне от приблизительно 200°С до приблизительно 350°С. В дополнение к значительному улучшению эксплуатационных характеристик спиртовых топливных элементов относительно высокие рабочие температуры спиртовых топливных элементов изобретения могут сделать возможным замещение дорогостоящих металлических катализаторов, таких как Pt/Ru и Pt на аноде и катоде соответственно менее дорогими материалами катализаторов. Следующие далее примеры и сравнительные примеры иллюстрируют превосходные эксплуатационные характеристики спиртовых топливных элементов изобретения. Однако данные примеры представлены только для целей иллюстрации и не должны восприниматься в качестве ограничения изобретения данными примерами. Пример 1. Метанольный топливный элемент В качестве анодного электрокатализатора использовали 13 мг/см2 Pt/Ru. В качестве катализатора внутреннего риформинга использовали Си (30% мacc.) - Zn (20% масс.) - Аl. В качестве катодного электрокатализатора использовали 15 мг/см2 Pt. В качестве электролита использовали мембрану из Csh3PO4 с толщиной 160 мкм. Превращенные в пар смеси метанола и воды подавали в анодное пространство с расходом 100 мкл/мин. На катод с расходом 50 см3/мин (стандартные температура и давление) подавали 30%-ный увлажненный кислород. Соотношение метанол: вода составляло 25:75. Температуру элемента задавали равной 260°С. Пример 2. Этанольный топливный элемент В качестве анодного электрокатализатора использовали 13 мг/см2 Pt/Ru. В качестве катализатора внутреннего риформинга использовали Си (30% мacc.) - Zn (20% масс.) - Аl. В качестве катодного электрокатализатора использовали 15 мг/см2 Pt. В качестве электролита использовали мембрану из Csh3PO4 с толщиной 160 мкм. Превращенные в пар смеси этанола и воды подавали в анодное пространство с расходом 100 мкл/мин. На катод с расходом 50 см3/мин (стандартные температура и давление) подавали 30%-ный увлажненный кислород. Соотношение этанол: вода составляло 15:85. Температуру элемента задавали равной 260°С. Сравнительный пример 1 - Топливный элемент с использованием чистого Н2 В качестве анодного электрокатализатора использовали 13 мг/см2 Pt/Ru. В качестве катодного электрокатализатора использовали 15 мг/см2 Pt. В качестве электролита использовали мембрану из Csh3PO4 с толщиной 160 мкм. В анодное пространство с расходом 100 мкл/мин подавали 3%-ный увлажненный водород. На катод с расходом 50 см3/мин (стандартные температура и давление) подавали 30%-ный увлажненный кислород. Температуру элемента задавали равной 260°С. На фигуре 2 продемонстрированы кривые зависимостей между удельной мощностью и напряжением элемента для примеров 1 и 2 и сравнительного примера 1. Как показано, для метанольного топливного элемента (пример 1) достигается пиковая удельная мощность 69 мВт/см2, для этанольного (пример 2) топливного элемента достигается пиковая удельная мощность 53 мВт/см2, а для водородного топливного элемента (сравнительный пример 1) достигается пиковая удельная мощность 80 мВт/см2. Данные результаты показывают, что топливные элементы, полученные в соответствии с примером 1 и сравнительным примером 1, очень похожи, свидетельствуя о том, что метанольный топливный элемент, имеющий риформер, демонстрирует эксплуатационные характеристики, почти такие же хорошие, как и у водородного топливного элемента, что является существенным улучшением. Однако, как продемонстрировано в приведенных далее примерах и сравнительных примерах, в результате уменьшения толщины электролита достигается дополнительное увеличение удельной мощности. Пример 3 Топливный элемент изготавливали в результате суспензионного осаждения Csh3PO4 на пористый носитель из нержавеющей стали, который служил в качестве как газодиффузионного слоя, так и токосъемника. Слой катодного электрокатализатора сначала осаждали на газодиффузионный слой, а после этого спрессовывали перед осаждением слоя электролита. После этого осаждали слой анодного электрокатализатора с последующим размещением второго газодиффузионного электрода в качестве конечного слоя структуры. В качестве анодного электрода использовали смесь Csh3PO4, Pt (50 атомных мас.%) Ru, Pt (40% мacc.) - Ru (20% масс.), нанесенных на С (40% масс.), и нафталина. Соотношение компонентов в смеси Csh3PO4:Pt-Ru:Pt-Ru-C: нафталин составляло 3:3:1:0,5 (масс.). Использовали смесь в общем количестве 50 мг. Загрузки Pt и Ru составляли 5,6 мг/см2 и 2,9 мг/см2 соответственно. Площадь анодного электрода была равна 1,74 см2. В качестве катодного электрода использовали смесь Csh3PO4, Pt, Pt (50% масс.), нанесенной на С (50% масс.), и нафталина. Соотношение компонентов в смеси Csh3PO4:Pt:Pt-C: нафталин составляло 3:3:1:1 (масс.). Использовали смесь в общем количестве 50 мг. Загрузки Pt составляли 7,7 мг/см2. Площадь катода была равна 2,3-2,9 см1. В качестве катализатора риформинга использовали СuО (30% масс.) - ZnO (20% масс.) - Аl2O3, то есть СuО (31% мол.) - ZnO (16% мол.) - Аl2O3. Катализатор риформинга получали по способу совместного осаждения при использовании раствора нитрата меди, цинка и алюминия (общая концентрация металла составляла 1 моль/л) и водного раствора карбонатов натрия (1,1 моль/л). Осадок промывали деионизованной водой, отфильтровывали и высушивали на воздухе при 120°С в течение 12 часов. Высушенный порошок в количестве 1 г слегка спрессовывали до толщины 3,1 мм и диаметра 15,6 мм, а после этого прокаливали при 350°С в течение 2 часов. В качестве электролита использовали мембрану из Csh3PO4 с толщиной 47 мкм. Раствор метанол-вода (43% об. или 37% масс. или 25% мол. или 1,85 М метанола) подавали через стеклянный испаритель (200°С) с расходом 135 мкл/мин. Температуру элемента задавали равной 260°С. Пример 4 Топливный элемент получали в соответствии с приведенным выше примером 3, за исключением того, что через испаритель (200°С) при расходе 114 мкл/мин подавали не смесь метанол-вода, а смесь этанол-вода (36% об. или 31% масс. или 15% мол., или 0,98 М этанола). Пример 5 Топливный элемент получали в соответствии с приведенным выше примером 3, за исключением того, что при расходе 100 мкл/мин вместо смеси метанол-вода подавали водку (Absolut Vodka, Швеция) (40% об. или 34% масс., или 17% мол. этанола). Сравнительный пример 2 Топливный элемент получали в соответствии с приведенным выше примером 3, за исключением того, что вместо смеси метанол-вода использовали высушенный водород в количестве 100 стандартных кубических сантиметров в минуту, увлажненный горячей водой (70°С). Сравнительный пример 3 Топливный элемент получали в соответствии с приведенным выше примером 3, за исключением того, что никакого катализатора риформинга не использовали, а температуру элемента задавали равной 240°С. Сравнительный пример 4 Топливный элемент получали в соответствии со сравнительным примером 2, за исключением того, что температуру элемента задавали равной 240°С. На фигуре 3 продемонстрированы кривые зависимостей между удельной мощностью и напряжением элемента для примеров 3, 4 и 5 и сравнительного примера 2. Как показано, для метанольного топливного элемента (пример 3) достигается пиковая удельная мощность 224 мВт/см2, что представляет собой значительное увеличение удельной мощности в сопоставлении с топливным элементом, полученным в соответствии с примером 1 и имеющим намного более толстый электролит. Данный метанольный топливный элемент также демонстрирует резкое улучшение эксплуатационных характеристик в сопоставлении с метанольными топливными элементами, не использующими внутреннего риформера, что лучше продемонстрировано на фигуре 4. Этанольный топливный элемент (пример 4) также демонстрирует увеличенные удельную мощность и напряжение элемента в сопоставлении с этанольным топливным элементом, имеющим более толстую мембрану электролита (пример 2). Однако, как показано, метанольный топливный элемент (пример 3) демонстрирует лучшие эксплуатационные характеристики в сопоставлении с этанольным топливным элементом (пример 4). Для водочного топливного элемента (пример 5) достигаются удельные мощности, сопоставимые с соответствующими характеристиками этанольного топливного элемента. Как продемонстрировано на фигуре 3, метанольный топливный элемент (пример 3) демонстрирует эксплуатационные характеристики, приблизительно такие же хорошие, как и у водородного топливного элемента (сравнительный пример 2). На фигуре 4 продемонстрированы кривые зависимостей между удельной мощностью и напряжением элемента для сравнительных примеров 3 и 4. Как показано, для метанольного топливного элемента, не имеющего риформера, (сравнительный пример 3) достигаются удельные мощности, значительно меньшие в сопоставлении с соответствующими характеристиками, достигаемыми для водородного топливного элемента (сравнительный пример 4). Кроме того, на фигурах 2, 3 и 4 показано, что в сопоставлении с метанольным топливным элементом, не имеющим риформера (сравнительный пример 3), для метанольных топливных элементов, имеющих риформеры (примеры 1 и 3), достигаются значительно большие удельные мощности. Предшествующее описание было представлено для ознакомления с предпочтительными в настоящий момент вариантами реализации изобретения. Специалисты в соответствующей области техники и технологии, к которой относится данное изобретение, должны понимать то, что в описанные варианты реализации могут быть внесены изменения и модификации без значительного отклонения от принципов, объема и сущности данного изобретения. В соответствии с этим приведенное выше описание не должно восприниматься как относящееся только к конкретным описанным вариантам реализации, но скорее должно пониматься как согласующееся со следующей далее формулой изобретения, которая содержит наиболее полный и наиболее объективный объем изобретения, и обосновывающее ее. 1. Топливный элемент, включающий: анодный электрокаталитический слой, катодный электрокаталитический слой, слой электролита, содержащий твердую кислоту, газодиффузионный слой и катализатор внутреннего риформинга, расположенный рядом с анодным электрокаталитическим слоем, так, что катализатор внутреннего риформинга расположен между анодным электрокаталитическим слоем и газодиффузионным слоем и находится в физическом контакте с анодным электрокаталитическим слоем. 2. Топливный элемент по п.1, где твердый кислотный электролит содержит Csh3PO4. 3. Топливный элемент по п.1, где катализатор риформинга выбирают из группы, состоящей из смесей оксидов Cu-Zn-Al, смесей оксидов Cu-Co-Zn-Al и смесей оксидов Cu-Zn-Al-Zr. 4. Способ эксплуатации топливного элемента, включающий:формирование анодного электрокаталитического слоя;формирование катодного электрокаталитического слоя;формирование слоя электролита, содержащего твердую кислоту;формирование газодиффузионного слоя иформирование катализатора внутреннего риформинга рядом с анодным электрокаталитическим слоем, так, что катализатор внутреннего риформинга расположен между анодным электрокаталитическим слоем и газодиффузионным слоем и находится в физическом контакте с анодным электрокаталитическим слоем;подачу топлива; и эксплуатацию топливного элемента при температуре в диапазоне от приблизительно 100°С до приблизительно 500°С. 5. Способ по п.4, где топливом является спирт. 6. Способ по п.4, где топливо выбирают из группы, состоящей из метанола, этанола, пропанола и диметилового эфира. 7. Способ по п.4, где топливный элемент эксплуатируют при температуре в диапазоне от приблизительно 200°С до приблизительно 350°С. 8. Способ по п.4, где катализатор риформинга выбирают из группы, состоящей из смесей оксидов Cu-Zn-Al, смесей оксидов Cu-Co-Zn-Al и смесей оксидов Cu-Zn-Al-Zr. 9. Способ по п.4, где электролит содержит твердую кислоту. 10. Способ по п.9, где твердая кислота содержит Csh3PO4. 11. Способ эксплуатации топливного элемента, включающий:формирование анодного электрокаталитического слоя;формирование катодного электрокаталитического слоя;формирование слоя электролита, содержащего твердую кислоту;формирование газодиффузионного слоя иформирование катализатора внутреннего риформинга рядом с анодным электрокаталитическим слоем, так, что катализатор внутреннего риформинга расположен между анодным электрокаталитическим слоем и газодиффузионным слоем и находится в физическом контакте с анодным электрокаталитическим слоем;подачу топлива; и эксплуатацию топливного элемента при температуре в диапазоне от приблизительно 200°С до приблизительно 350°С. 12. Способ по п.11, где топливом является спирт. 13. Способ по п.11, где топливо выбирают из группы, состоящей из метанола, этанола, пропанола и диметилового эфира. 14. Способ по п.11, где катализатор риформинга выбирают из группы, состоящей из смеси оксидов Cu-Zn-Al, смесей оксидов Cu-Co-Zn-Al и смесей оксидов Cu-Zn-Al-Zr. 15. Способ по п.11, где электролит содержит твердую кислоту. 16. Способ по п.15, где твердая кислота содержит Csh3PO4. 17. Способ эксплуатации топливного элемента, включающий:формирование анодного электрокаталитического слоя;формирование катодного электрокаталитического слоя;формирование слоя электролита, содержащего твердую кислоту;формирование газодиффузионного слоя иформирование катализатора внутреннего риформинга рядом с анодным электрокаталитическим слоем, так, что катализатор внутреннего риформинга расположен между анодным электрокаталитическим слоем и газодиффузионным слоем и находится в физическом контакте с анодным электрокаталитическим слоем;подачу спиртового топлива; и эксплуатацию топливного элемента при температуре в диапазоне от приблизительно 100°С до приблизительно 500°С. 18. Способ по п.17, где топливо выбирают из группы, состоящей из метанола, этанола, пропанола и диметилового эфира. 19. Способ по п.17, где топливный элемент эксплуатируют при температуре в диапазоне от приблизительно 200°С до приблизительно 350°С. 20. Способ по п.17, где катализатор риформинга выбирают из группы, состоящей из смесей оксидов Cu-Zn-Al, смесей оксидов Cu-Co-Zn-Al и смесей оксидов Cu-Zn-Al-Zr. 21. Способ по п.17, где твердый кислотный электролит содержит Csh3PO4. 22. Способ эксплуатации топливного элемента, включающий:формирование анодного электрокаталитического слоя;формирование катодного электрокаталитического слоя;формирование слоя электролита, содержащего твердую кислоту;формирование газодиффузионного слоя иформирование катализатора внутреннего риформинга рядом с анодным электрокаталитическим слоем, так, что катализатор внутреннего риформинга расположен между анодным электрокаталитическим слоем и газодиффузионным слоем и находится в физическом контакте с анодным электрокаталитическим слоем;подачу спиртового топлива; и эксплуатацию топливного элемента при температуре в диапазоне от приблизительно 200°С до приблизительно 350°С. 23. Способ по п.22, где топливо выбирают из группы, состоящей из метанола, этанола, пропанола и диметилового эфира. 24. Способ по п.22, где катализатор риформинга выбирают из группы, состоящей из смесей оксидов Cu-Zn-Al, смесей оксидов Cu-Co-Zn-Al и смесей оксидов Cu-Zn-Al-Zr. 25. Способ по п.22, где твердый кислотный электролит содержит Csh3PO4.
www.findpatent.ru Состав анолита. Подобно процессу восстановления, протекание электролитического окисления может зависеть от анолита. В кислом растворе анилин окисляется до черного анилина, в то время как в щелочном растворе главным продуктом окисления является азобензол. Низшие спирты окисляются в кис-.дом растворе до альдегидов и кислот в щелочном же растворе, помимо альдегидов и кислот, образуется также анодный водород (см. стр. 342 в работе [15]). [c.346] Соли довольно часто применяются как фоновые электролиты при электровосстановлении или электроокислении органических соединений в водной среде. Восстанавливаться на катоде на фоне солей могут ацетиленовые углеводороды и спирты до этиленовых производных, лактоны, карбонильные соединения до спиртов. Соли являются также электролитами при гидродимеризации альдегидов и кетонов, ненасыщенных карбоновых кислот и их производных, активированных олефинов, а также в реакциях дегалогенирования. Соли используются в качестве электролитов в реакциях электролитического окисления карбоновых кислот (реакция Кольбе, Брауна — Уокера), в процессах алкоксилирования. [c.99] Необратимые процессы [3]. Реакции необратимого типа, т. е. реакции в системах, в которых не устанавливаются обратимые равновесные потенциалы, наиболее часто встречаются в случае органических соединений, не диссоциирующих на ионы. Катодное восстановление нитробензола в анилин и анодное окисление спирта в уксусную кислоту являются примерами процессов этого типа. Вероятно, необратимы также некоторые неорганические реакции, например электролитическое восстановление азотной кислоты и нитратов в гидроксиламин и аммиак или анодное окисление ионов трехвалентного хрома в хромат-ионы. Хотя проблемы электролитического окисления и восстановления были предметом многочисленных экспериментальных исследований, точный механизм протекающих при этом реакций остается все еще спорным. Так, например, электролитическое восстановление соединения НО в К может быть представлено уравнением [c.672] Электролитическое окисление. Потенциал электрода. В присутствии деполяризатора на аноде трудно бывает получить устойчивые потенциалы любой желаемой величины. Как общее правило, потенциал анода быстро растет от низкого значения, при котором анод растворяется, до высокого значения, отвечающего пассивному состоянию анода и выделению кислорода. Однако, так как платиновый электрод почти всегда пассивен, иа нем можно в ограниченных пределах изменять потенциал. Данные, приведенные в табл. 86, были получены при окислении кислого раствора этилового спирта на платиновом аноде при разных потенциалах [7]. Как видно из этих данных, по мере возрастания анодного потенциала процент содержания уксусной кислоты в продуктах окисления увеличивается. [c.679] Как указывалось ранее, большинство процессов электролитического окисления или восстановления органических соединений протекает необратимо. Имеются, однако, некоторые заслуживающие внимания исключения, например переход хинона в гидрохинон, лейкооснования в окрашенную форму трифенилметановых красителей и т. д. Однако эти системы редки, и в общем случае мы должны довольствоваться эмпирическими данными. Необратимая система не дает определенного потенциала, который изменялся бы в соответствии с количеством окисленной и восстановленной формы, как это получается в случае применения термодинамического выражения для потенциала обратимой системы. Потенциал необратимых систем зависит больше от природы среды (степени ее кислотности или щелочности) и природы электрода, чем от концентраций окисленной и восстановленной форм. Поэтому невозможно применить простые термодинамические принципы, которые справедливы для обратимых электродных процессов. Следует помнить, что существует четкое различие между химической и термодинамической обратимостью. Переход кетона во вторичный спирт может быть обратимым, но этому равновесному переходу не обязательно будет соответствовать определенный термодинамически обратимый потенциал. Это не означает, что кетон, электролитически восстановленный до спирта, не может быть снова электролитически окислен до кетона. Такое окисление возможно, но для осуществления его потребуются совершенно другие условия в отношении потенциала, pH среды и. материала электрода. [c.12] Известен также способ получения янтарной кислоты путем электролитического окисления фурфурола [70] или тетрагидрофурфурилового спирта [71] в разбавленном растворе кислот или солей. [c.63] Механизм процесса электролитического окисления бутиролактона и тетрагидрофурфурилового спирта изучался японскими исследователями [89]. Янтарную кислоту получали с хорошим выходом при использовании свинцового катода и анода из двуокиси свинца. [c.66] Из других процессов электролитического окисления кроме описываемого ниже производства перекисей отметим получение хромовокислых солей, многочисленных органических соединений (окисление спиртов до кислот) и т. д. [c.448] При проведении электролитического восстановления многие органические соединения можно перевести в водный раствор добавлением к католиту определенных количеств какого-нибудь растворимого органического соединения, например одного из низших спиртов, обычно этилового (см. примеры реакций восстановления, стр. 332 и сл.). Если эту операцию осуществить при проведении окисления, то соединение, добавляемое для повышения растворимости, окисляется вместе с тем органическим соединением, которое нужно окислить. В некоторых случаях, как указано выше, можно употреблять неводные рас- [c.324] Нами изучено окисление этилового спирта на Pt-черни. В каждом опыте использовали 0,1 г платины. Навеска спирта 0,77 мл (0,616 г) эквивалентна поглощению 300 мл кислорода при окислении до кислоты. Применяли электролитический кислород. Растворитель — 30 мл бидистиллята. Перед началом опыта катализатор насыщали кислородом до установления потенциала, близкого к обратимому кислородному (величина э.д.с. при обратимом кислородном потенциале равна 659 мв по 0,1 н. окисно-ртутному электроду при pH 7). После введе- [c.429] Окисляемость реактивных топлив мы оценивали в приборе ЛСА. Топлива окисляли кислородом воздуха в присутствии металлического катализатора (пластинки из электролитической меди) при 110° С. Критерием оценки служило образование в топливе за 8—10 ч окисления потенциальных смол, нерастворимых в топливе смол (но растворимых в полярных растворителях — спирто-бензольной смеси) и осадка (нерастворимого и в полярных растворителях) [12, 13]. [c.259] Из этого уравнения видно, что 70% иода не используется в процессе. Этот иод может быть регенерирован путем окисления его хлором или раствором гипохлорита до свободного иода, который вновь возвращается в процесс. Практическая целесообразность такого процесса сомнительна. В электролитическом процессе среда состоит из щелочного раствора спирта, содержащего иодистый калий. Пропускаемый ток служит только для разряда ионов иода на аноде, так как измерения потенциала показывают, что этиловый спирт не является деполяризатором при этих условиях [41]. Суммарный процесс на аноде можно выразить следующим образом [c.163] Неэлектролиты, подобные ацетону и спиртам, могут быть деионизованы методом, который используется для воды. Эти методы применимы к почти безводным органическим жидкостям и их водным растворам. В первом случае ионы поглощаются смолой медленнее, чем из водных растворов. Концентрация неэлектролитов в начальных порциях фильтрата из ионообменной колонки может отличаться от исходной, так как смолы в присутствии воды могут их сорбировать. Основная электролитическая примесь в низших первичных спиртах и в водном растворе формальдегида — кислота, образовавшаяся в результате окисления этих веществ атмосферным кислородом. Чтобы удалить кислоту, во многих случаях достаточно пропустить раствор через колонку анионообменника в ОН -форме. Так как сильноосновная смола катализирует полимеризацию формальдегида, для удаления кислоты из формальдегида применяется только слабоосновная смола [1а]. [c.90] Полярографически неактивные вещества можно обнаружить в том случае, если ввести в испытуемое соединение активную группировку. Например, для обнаружения примеси метилового спирта в этиловом было предложено окислять пробу спирта хромовой смесью или электролитическим путем, при этом метиловый спирт образует формальдегид, а этиловый—уксусный альдегид. На полярограмме окисленной пробы в случае присутствия даже минимальных следов метилового спирта в исходном этиловом образуются две четкие волны, первая из которых обусловлена формальдегидом. В отсутствие метанола на полярограмме обнаруживается только одна волна, соответствующая уксусному альде- [c.37] Исходным материалом для сухозаряженных цинковых электродов может быть электролитический порошок цинка, тщательно отмытый и высушенный в условиях, исключающих его окисление. Подобный порошок получается электролизом цинкатных растворов в виде губчатого осадка на никелевых или никелированных катодах [Л. 9]. К высушенному цинковому порошку, содержащему около 90%, металлического цинка, добавляется 1,0—1,5% НдО для замедления саморазряда электрода в щелочном электролите. Порошкообразная масса без специального связующего вещества напрессовывается под давлением около 50 кГ/см на медный токоотвод. В качестве оболочки цинкового электрода используется пленка поливинилового спирта, которая в отличие от целлофана не подвергается разрушающему воздействию ионов куприта. [c.209] К процессам электролитического окисления следует отнести также процессы хлорирования, фторирования, бромирования и иодирования на аноде. Такие реакции применяются главным образом при электросинтезе органических соединений, например, для хлорирования бензола или этилена, фторирования и бромирования углеводородов, получения йодоформа. Теория этих процессов изучена очень мало Изгарышев и Горбачев считают, что первично на аноде выделяется галоид, который уже вторично взаимодействует с веществом, подлежащим галоидированию (бензол, толуол, спирт и т. д.) непосредственно или с промежуточным образованием в водных растворах хлорноватистых, иодноватистых и других соединений. Очевидно, электрогалоидирование в ряде случаев должно идти аналогично электроокислению. [c.119] Средства окисления углеводородов — не совсем обычны таковы, например, электролитическое окисление в растворах Н2504, токн. Тесла, бихромат или КМп04 с Н2504, Оз и т. д. Наоборот, окисление фенолов проходит легко их окисление до образования смолы часто представляет нежелательный побочный процесс, например, при использовании крезола для адсорбции летучих растворителей (ацетон, спирт и т. д.) [c.580] Состав анолита. Подобно восстановлению, направление электролитического окисления может зависеть от анолита. Анилин окисляется до черного анилина в кислом растворе, в то время как в щелочйом растворе главным продуктом является азобензол. Низшие спирты в кислом растворе окисляются до альдегидов и кислот в щелочном растворе, помимо альдегидов и кислот, образуется также и анодный водород. [c.50] Через стадию образования акролеина протекает также окисление аллилового спирта воздухом на платиновом контакте [1888] или электролитическое окисление в среде серной кислоты [1884]. В обоих случаях (особенно в нервом) выход акриловой кислоты низкий. В противоположность этому каталитическое окисление металлилового спирта воздухом на топкоразмель-ченной меди протекает исключительно благоприятно [1888а]. [c.396] При восстановлении, в ряде случаев, частично образуется уран (III), который легко и быстро окисляется до урана (IV) кислородом воздуха. Уран (VI) можно количественно восстановить до урана (IV) электролитически на ртутном катоде [8, 260, 861], фотохимически спиртом [829], эфиром [833], или молочной кислотой [828] в азотнокислом растворе уран (IV) можно получить восстановлением уранил-нитрата ронгалитом [57] удобным восстановителем урана (VI) до урана (IV) является двуокись тиомочевины (Nh3)2 S02[48,48а] и гидросульфит натрия Na2S204[8, 184]. Кислые растворы четырехвалентного урана довольно устойчивы в темноте и на холоде [8]. Показано, что окисление урана (IV) воздухом су-ш.ественно ускоряется под влиянием света, особенно прямого солнечного или ультрафиолетового [263] при этом процесс окисления протекает следующим образом [c.28] Материал анода. Согласно имеющимся данным, единственным анодным материалом для электролитического тио- и селеноцианирования является уголь. Для галогенирования (как прямого, так и непрямого) в водном растворе применяли гладкую платину. В метиловом спирте использовали также уголь, а в случае фторирования—никель. При окислении гипобромитом и для реакций присоединения применяли угольные аноды. [c.348] Коэл [49] показал, что при электролизе с угольными анодами продуктов реакции Кольбе не образуются даже кислоты, не содержащие заместителей в а-положении. Окисление ацетата, пропионата и бутирата он рассматривает как двухэлектронную электрохимическую реакцию, включающую потерю двуокиси углерода и образование горячего карбониевого иона, который может либо элиминироваться с образованием олефинов, либо гидрироваться кроме того, возможна также миграция метильной группы, в результате чего образуются более устойчивые промежуточные продукты, которые затем образуют олефины или продукты замещения. Коэл отметил, что смеси, получающиеся после электролитического генерирования карбониевых ионов, обычно отличаются от смесей, получающихся при дезаминировании аминов или восстановлении спиртов. Он объяснил это большей энергией электролитически генерированных ионов. Очевидная зависимость результатов реакции от метода генерирования карбониевых ионов отмечалась выше при обсуждении образования бицикло[3,1,0]гексил-иона [42]. [c.145] Непрямое окисление этилена в уксусную кислоту может быть осуществлено превращением его в эт)4ловый спирт (см. гл. 13), который затем окисляется в эфир уксусной кислоты 1) электролитически, 2) хромовой кислотой или перманганатом калия или 3) воздухом Stra he описал метод, в котором ненасыщенные углеводороды, получаемые из различных источников, этерифицируются минеральной кислотой, например серной, а затем окисляются бихроматом ка.шя. Летучие кислоты могут быть отделены от остальных продуктов перегонкой с водяным паром. [c.1004] Старые методы получения хлороформа состояли в электролизе разбавленного спиртового раствора хлоридов щелочных металлов, причем главным образом происходило окисление спирта, а хлороформ получался в небольшом количестве как побочный продукт 8]. Такой результат не является неожиданным, учитывая, что кислород в щелочной среде выделяется при значительно более низком потенциале, чем в кислой среде. Некоторое увеличение выхода было достигнуто в водном растворе хлористого кальция при плотности тока 0,08 а см и температуре 50—70° [9]. В этом случае щелочность среды регулируется в результате осаждер.ия гидроокиси кальция. Однако при этом возникает то затруднение, что образующаяся гидроокись кальция, осаждаясь на электроде, препятствует прохождению тока. Весьма тщательное изучение условий электролитического получения хлороформа было проведено Фейером [10]. Применяя платиновый анод, плотность тока примерно I а см и нейтрализующий катод по методу Роуша [11] в среде, содержащей 20% раствор хлористого калия, удалось получить хлороформ с выходом по току 65—75%. Этот метод оказался пригодным как для превращения этилового спирта, так и ацетона. Однако при использовании этилового спирта требуется температура около 30°, в то время как для ацетона желательна температура около 15°. Далее, Фейер установил, что можно полу- [c.155] Надсерная кислота и ее соли, получаемые электрохимическим методом путем окисления серной кислоты или сульфатов на аноде, являются полупродуктами в производстве перекиси водорода. До начала 50-х годов производство перекиси водорода основывалось преимущественно на гидролизе электролитических надсерной кислоты и ее солей. В настоящее время лишь 36% мирового производства перекиси водорода базируется на переработке надсерной кислоты и персульфатов, 56% Н2О2 производится химическим методом через антрахинон, 8% получается через изопропиловый спирт 1265]. В СССР электрохимический метод является основным с его помощью производится 80% всей перекиси водорода [3]. [c.79] Другим типом весового кулонометра является медный, показанный на рис. 11. Медный кулонометр представляет собой прямоугольный стеклянный сосуд, на двух противоположных стенках которого подвешены пластины из электролитической меди, служащие анодами, а между ними помещена тонкая медная пластина, служащая катодом. В качестве электролита используют водный раствор, содержащий сульфат меди uS04-5h30 (125—150 кг/м ), серную кислоту h3SO4 (50 кг/м ) и этиловый спирт. Добавка этилового спирта в раствор предотвращает возможность окисления выделяющейся на катоде меди. [c.46] chem21.infoэлектролит для электрохимической обработки. Спирт электролит. Спирт электролит
Электролиты и неэлектролиты
электролит для электрохимической обработки. Спирт электролит
Электролиты и неэлектролиты
Электропроводность спиртов - Справочник химика 21
СРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ СПИРТА, РАСТВОРА ЩЕЛОЧИ В СПИРТЕ И РАСТВОРА ЩЕЛОЧИ [c.33]Электропроводность спиртов - Справочник химика 21
СРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ СПИРТА, РАСТВОРА ЩЕЛОЧИ В СПИРТЕ И РАСТВОРА ЩЕЛОЧИ [c.33]Назовите какие нибудь электролиты и неэлектролиты!
Электролитическое окисление спиртов - Справочник химика 21
Электролитическое окисление спиртов в кислоты [c.358]Спиртовые топливные элементы прямого действия, использующие твердые кислотные электролиты
Спирт, электролитическое окислени - Справочник химика 21
Диалкокси-2,5-дигидрофураны можно получить электролитическим окислением фурана в спиртовом растворе бромистого аммония или окислением фурана бромом в соответствующем спирте. [c.46]

 Добавить сайт в избранное
Добавить сайт в избранное
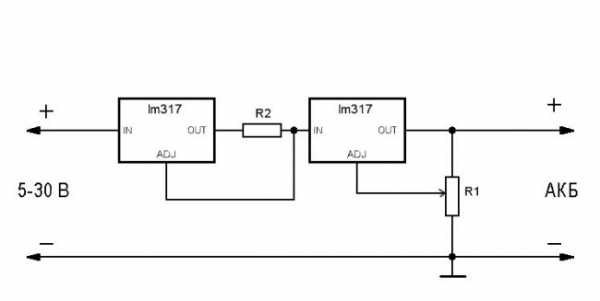












.jpg)

